Контрацептивные вакцины
Исследования по созданию вакцин, взывающих контрацепцию у людей, ведутся с конца 1920-х гг. С 1972 г. контрацептивные вакцины являются одной из приоритетных программ Всемирной организации здравоохранения (WHO Special Programme of Research, Development and Research Training in Human Reproduction). В осуществлении программы принимает участие Фонд Рокфеллера (Rockefeller Foundation) Открыто декларируемая цель создания таких вакцин – регуляция численности населения в странах Третьего мира. К настоящему времени сложились три основных направления конструирования контрацептивных вакцин: 1) вакцины, ориентированные на блокирование производства гамет; 2) нарушающие их функцию; 3) нарушающие процесс оплодотворения. Контрацептивные вакцины уже более 10 лет широко используются для снижения фертильности и кастрации диких и домашних животных. В коммерческой реализации находятся ветеринарные вакцины Equity®, Improvac®, GonaCon®, Repro-BLOC (на основе гонадоторопин-рилизинг-гормона); SpayVacTM и IVT-PZP® (на основе антигенов zona pellucida). Клинические исследования показали эффективное контрацептивное действие (у женщин) вакцин, использующих в качестве антигена человеческий хорионический гонадотропин. В тоже время обнаружены и побочные действия таких вакцин: для вакцин, содержащих в качестве антигенных компонентов гонадоторопин-рилизинг-гормон и лютеинизирующий гормон – кастрация, развитие импотенции; для содержащих фолликулостимулирующий гормон – олигоспермия; антигены zona pellucida – необратимый оофарит. В работе обсуждаются подходы к обнаружению стерилизующих компонентов в вакцинах, предназначенных для массовой профилактики инфекционных болезней, не заявленных производителями, и последствий их применения. Уже осуществленное скрытое применение вакцин контрацепции можно предположить: 1) по наличию антител к их антигенным компонентам (у невакцинированных контрацептивными вакцинами людей таких антител не бывает за исключением случаев, связанных с бесплодием); 2) по изменению гормонального фона вакцинированного пациента; 3) по нарушению функционирования и патогистологическим изменениям в органах репродуктивной системы.
Библиографическое описание: Супотницкий М.В. Контрацептивные вакцины // Актуальная инфектология. — 2014. – № 1. — С. 67–89.
Summary. Researches to develop vaccines with contraceptive effect are being carried out since the 1920s. Since 1972, the contraceptive vaccines are one of the priority programs of the World Health Organization (WHO Special Programme of Research, Development and Research Training in Human Reproduction). Rockefeller Foundation participates in implementing the program. Openly declared objective of creating such vaccines — the regulation of the population in the Third World countries. There are currently three main directions of contraceptive vaccine design: 1) vaccines targeted at blocking the production of gametes; 2) impairing their function; 3) violating the fertilization process. Contraceptive vaccines for more than 10 years are widely used to reduce fertility and castration of wild and domestic animals. In the commercial realization there are veterinary vaccines Equity®, Improvac®, GonaCon®, ReproBLOC (based on gonadotropin-releasing hormone); SpayVac™ and IVT-PZP® (based on zona pellucida antigens). Clinical studies have shown effective contraceptive action (in women) of vaccines, in which human chorionic gonadotropin is used as an antigen. At the same time, there are found the side effects of such vaccines: for vaccines containing gonadotropin-releasing hormone and luteinizing hormone as antigenic components — castration, impotence; for vaccines containing follicle stimulating hormone — oligospermia; zona pellucida antigens — irreversible oophoritis. This paper discusses approaches to detection of sterilizing components in vaccines intended for mass prevention of infectious diseases, not reported by manufacturers, and the consequences of their use. Hidden use of contraceptive vaccines, which already took place, can be detected: 1) by the presence of antibodies to their antigenic components (in unvaccinated by contraceptive vaccines people such antibodies do not exist, except infertility cases); 2) by change in the hormonal levels of the vaccinated patients; 3) by malfunction and histopathological changes in the reproductive organs.
Bibliographical description: Supotnitskiy М.V Contraceptive vaccines // Actual Infectology. — 2014. – № 1. — P. 67–89.
Резюме. Дослідження зі створення вакцин, що мають контрацептивний ефект, ведуться з кінця 1920-х рр. З 1972 р. контрацептивні вакцини є однією з пріоритетних програм Всесвітньої організації охорони здоров'я (WHO Special Programme of Research, Development and Research Training in Human Reproduction). У здійсненні програми бере участь Рокфеллерівський фонд (Rockefeller Foundation). Відкрито декларована мета створення таких вакцин — регуляція чисельності населення в країнах третього світу. На даний час склалися три основних напрямки конструювання контрацептивних вакцин: 1) вакцини, орієнтовані на блокування вироблення гамет; 2) такі, що порушують їх функцію; 3) такі, що порушують процес запліднення. Контрацептивні вакцини вже понад 10 років широко використовуються для зниження фертильності й кастрації диких і свійських тварин. У комерційній реалізації знаходяться ветеринарні вакцини Equity®, Improvac®, GonaCon®, Repro-BLOC (на основі гонадотропін-рилізинг-гормону); SpayVacTM і IVT-PZP® (на основі антигенів zona pellucida). Клінічні дослідження показали ефективну контрацептивну дію (ужінок) вакцин, у яких як антиген використовується людський хоріонічний гонадотропін. У той же час виявлені й побічні дії таких вакцин: для вакцин, що містять як антигенні компоненти гонадотропін-рилізинг-гормон і лютеїнізуючий гормон, — кастрація, розвиток імпотенції; для тих, що містять фолікулостимулюючий гормон, — олігоспермія; антигени zona pellucida — необоротний оофорит. У роботі обговорюються підходи до виявлення стерилізуючих компонентів у вакцинах, призначених для масової профілактики інфекційних хвороб, не заявлених виробниками, і наслідків їх застосування. Уже здійснене приховане застосування контрацептивних вакцин можна припустити: 1) за наявністю антитіл до їх антигенних компонентів (у не вакцинованих контрацептивними вакцинами людей таких антитіл не буває, за винятком випадків, пов'язаних із безплідністю); 2) за зміною гормонального фону вакцинованого пацієнта; 3) за порушенням функціонування й патогістологічними змінами в органах репродуктивної системи.
Библиографическое описание: Супотницький М.В. Контрацептивнi вакцини // Актуальна iнфектологiя. — 2014. – № 1. — С. 67–89.
За рубежом исследования по созданию контрацептивных вакцин для людей ведутся с конца 1920-х гг. В публикациях ученых, разрабатывающих такие вакцины, обычно подчеркивается, что необходимость в них вызвана ростом численности населения планеты, особенно в странах третьего мира (см., например, [2, 42, 64]). Ряд западных политиков, придерживающихся неомальтузианских взглядов (neo-malthusianism) [29], высказались о необходимости сокращения численность населения путем массовых вакцинаций контрацептивными вакцинами [12]. Цель данной работы – рассмотреть существующие подходы к конструированию контрацептивных вакцин, и определить основные признаки, по которым можно распознать их скрытое применение.
История создания контрацептивных вакцин. Началась в 1899 г. когда австрийский иммунолог Карл Ландштейнер (Karl Landsteiner, 1868–1943) и русский ученый Илья Мечников (1845–1916), работавшие в Институте Пастера (Pasteur Institute, Париж), независимо друг от друга продемонстрировали, что инъекция гетероспецифической спермы может вызывать антительный ответ у экспериментального животного [25, 32]. В 1929 г. Morris J. Baskin, клинический директор Комитета гигиены матерей Денвера (Denver Maternal Hygiene Committee, США), использовал человеческую сперму для временной стерилизации женщин [5]. В 1937 г. им получен патент на неспецифическую сперматоксичную вакцину и способ ее получения (рис. 1).
 Рис. 1. Титул патента Morris J. Baskin на неспецифическую сперматоксичную вакцину и способ ее получения [6].
Рис. 1. Титул патента Morris J. Baskin на неспецифическую сперматоксичную вакцину и способ ее получения [6].
Активным сторонником иммуноконтрацепции был британский ученый, лауреат Нобелевской премии по физиологии и медицины (2010) Роберт Эдвардс (Robert Edwards, 1925–2013) [11], основной разработчик технологии экстракорпорального оплодотворения [41]. С 1972 г. контрацептивные вакцины являются приоритетной программой Всемирной организации здравоохранения (WHO Special Programme of Research, Development and Research Training in Human Reproduction). В осуществлении программы принимает участие Фонд Рокфеллера (Rockefeller Foundation) [12, 52]. До начала 1970-х гг. сперма являлась основным объектом исследований по поиску антигенных детерминант контрацептивных вакцин, предназначенных для людей и животных. За последние 40 лет сложились три основных направления конструирования контрацептивных вакцин: 1) блокирующие образование гамет; 2) нарушающие их функцию; 3) нарушающие формирование зародыша и его имплантацию в матку (нарушающие процесс оплодотворения) (рис. 2). В табл. 1 показан достигнутый уровень конструирования и возможные ограничения для медицинского применения контрацептивных вакцин.
Таблица 1. Достигнутый уровень конструирования контрацептивных вакцин и их возможные ограничения для медицинского применения [41]
|
Антиген |
Пол вакцинируемого |
Основные ограничения |
Коммерчески доступные вакцины |
Животные, у которых удалось осуществить контрацепцию |
Использование у людей |
|
|
|
|
Контрацепция |
Возможное неконтрацептивное использование |
|||
|
Гонадотропин- рилизинг-гормон (gonadotropin-releasing hormone, GnRH) |
Мужской и женский |
Развитие импотенции |
Equity®, Improvac®, GonaCon®, Repro-BLOC® |
Самцы и самки вида кошачьих |
Не исследовалась |
Уменьшение продукции мужских половых гормонов при гипертрофии и раке простаты, и чрезмерной гормональной редукции у женщин при фиброме матки, эндометриозе, полицистозе яичников, преждевременном наступлении половой зрелости |
|
Фолликулостимулирующий гормон (follicle-stimulating hormone, FSH) |
То же |
Развитие олигоспермии |
Нет |
Человекообразные приматы |
Случаи олигоспермии |
Неизвестно |
|
Лютеинизирующий гормон (luteinizing hormone, LH) |
То же |
Развитие импотенции |
Нет |
Лабораторные животные и человекообразные приматы |
Исследования не проводились |
Неизвестно |
|
Человеческий хорионический гонадотропин (human chorionic gonadotropin, hCG) |
Женский |
Трудно достичь высокого титра антител |
Нет |
Человекообразные приматы |
Положительный результат |
hCG-секретирующие опухоли |
|
Антигены Zona pellucida (ZP) |
Тоже |
Вызывает необратимый оофарит |
SpayVacTM и IVT-PZP® |
Шесть видов диких животных, собаки, человекообразные приматы |
Исследования не проводились |
Может быть найдено применение при лечении рака яичников |
|
Антигены спермы |
Мужской и женский |
Ограничения неизвестны |
Информация отсутствует |
Различные лабораторные животные и человекообразные приматы |
Ожидаются положительные результаты |
Может быть найдено применение при лечении рака яичек |
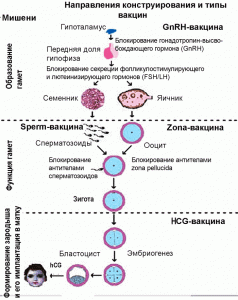 Рис. 2. Основные направления конструирования контрацептивных вакцин. На схеме показаны процесс оплодотворения и образования зародыша у человека, основные мишени контрацепции и типы контрацептивных вакцин [41]
Рис. 2. Основные направления конструирования контрацептивных вакцин. На схеме показаны процесс оплодотворения и образования зародыша у человека, основные мишени контрацепции и типы контрацептивных вакцин [41]
Основные отличия контрацептивных вакцин от вакцин, используемых для специфической профилактики инфекционных болезней. В 1978 г. V.C. Stevens [64] сформулировал два основных отличия контрацептивных вакцин от традиционных. Во-первых, антигены контрацептивных вакцин могут быть выбраны только из биологически активных молекул, в норме не вызывающих иммунный ответ. То есть основной задачей разработчиков таких вакцин является либо нарушение иммунологической толерантности к таким молекулам, либо придание им «перекрестной активности» к молекулам, участвующим в репродуктивной функции человека. Во-вторых, контрацептивные вакцины должны блокировать развитие беременности на прогнозируемый период времени.
Гормональная регуляция фертильности человека. В основе регуляции фертильности человека находится действие гонадотропин-рилизинг-гормона (гонадорелин, гонадолиберин, гонадотропин-рилизинг-фактор, gonadotropin-releasing hormone, GnRH; luteinizing-hormone-releasing hormone, LHRH) и индуцируемых им гонадотропных гормонов передней доли гипофиза: фолликулостимулирующего гормона (фоллитропин, folliclestimulating hormone, FSH) и лютеинизирующего гормона (лютеотропин, лютропин, lutropin, lutrophin, luteinizing hormone, LH).
GnRH образуется секреторными клетками гипоталамуса (отдел промежуточного мозга). Гипоталамус формирует с гипофизом единый функциональный комплекс. GnRH непосредственно взаимодействует со специфическими рецепторами клеток-гонадотропов, расположенных в передней доле гипофиза, и вызывает усиление секреции FSH и LH. В большей степени GnRH влияет на секрецию лютеинизирующего, чем фолликулостимулирующего гормона. Благодаря действию FSH и LH на гонады, GnRH играет важную роль в регуляции репродуктивной функции у человека и животных. Он индуцирует синтез половых стероидных гормонов, сперматогенез и созревание фолликулов, влияет на сексуальное поведение [50].
FSH стимулирует у женщин развитие интерстициальной ткани яичников и овуляцию, что приводит к усиленной секреции женских половых гормонов — эстрогенов. У мужчин FSH вызывает развитие семенных канальцев, стимулирует сперматогенез и секрецию мужских половых гормонов — андрогенов.
Действие FSH и LH взаимосвязано и синергично. Под влиянием FSH созревающие фолликулы эстрогены, среди которых наибольшее значение имеет эстрадиол. Одновременно FSH индуцирует в фолликулах экспрессию рецепторов к LH. В результате к моменту созревания фолликула повышение уровня эстрадиола становится настолько высоким, что это приводит к активации гипоталамуса (т.е. GnRH) по принципу положительной обратной связи и интенсивному высвобождению LH и FSH гипофизом. Повышение уровня LH запускает овуляцию, при этом из яичника не только высвобождается яйцеклетка, но и инициируется процесс лютеинизации — превращения остаточного фолликула в жёлтое тело[1], которое, в свою очередь, начинает вырабатывать прогестерон для подготовки эндометрия к возможной имплантации. LH необходим для поддержания существования жёлтого тела примерно в течение 14 сут. В случае наступления беременности лютеиновая функция будет поддерживаться действием гормона трофобласта — хорионического гонадотропина (HCG). LH стимулирует клетки в яичниках, продуцирующие андрогены и предшественники эстрадиола [28].
HCG начинает образовываться плацентой плода с первых часов беременности. Его продукция возрастает в несколько тысяч раз к 7–11 неделе, затем постепенно снижается. Благодаря секреции значительных количеств HCG жёлтое тело, в норме существующее около 2 недель в течение каждого менструального цикла, у беременных не подвергается рассасыванию и остается функционально активным в течение всего срока беременности. Причём жёлтое тело у беременных под влиянием HCG производит большие количества прогестерона, физиологически невозможные в норме в небеременном организме. Схема гормональной регуляции фертильности человека приведена на рис. 3.
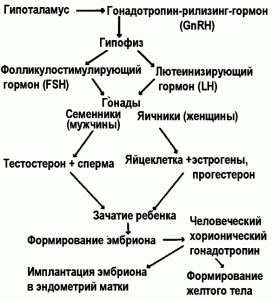 Рис. 3. Гормональная регуляция фертильности человека [70]
Рис. 3. Гормональная регуляция фертильности человека [70]
HCG обладает биологическими свойствами как LH, так и FSH. И связывается с обоими типами рецепторов к гонадотропинам. Лютеинизирующая активность у HCG значительно преобладает над фолликулостимулирующей. По лютеинизирующей активности он значительно превосходит «обычный» LH, производимый передней долей гипофиза.
Овечьи и человеческие гонадоторопины (LH, FSH) структурно сходны между собой. Антитела к этим гормонам обладают перекрестной нейтрализующей активностью [34, 36].
Вакцины, блокирующие образование гамет. К ним относятся вакцины, блокирующие действие GnRH; FSH и LH.
Вакцины на основе гонадотропин-рилизинг-гормона. GnRH представляет собой декапептид с молекулярной массой (ММ) 1182 Д, общий для большинства млекопитающих. Установлена важная роль первых трех аминокислотных остатков в молекуле GnRH для проявления им биологической активности и боковых цепей аминокислотных остатков в положениях 2, 3 и 6 для связывания с рецепторами клеток-гонадотропов. Модификация аминокислот в этих положениях позволила получить высокоактивные и длительно действующие аналоги GnRH.
Из-за небольшой ММ и простоты строения молекулы, антигенные свойства GnRH минимальны. В некоторых работах его рассматривают как гаптен [55]. Наименьшая ММ веществ, против которых удалось получить антитела без их присоединения к другим, более крупным молекулам, составляет примерно 1000 Д (вазопрессин, ангиотензин). Поэтому конструирование вакцин фертильности на основе GnRH с самого начала пошло по пути повышения его антигенных свойств. В конце 1980-х гг. для решения этой технической задачи использовалось конъюгирование GnRH с иммуностимулирующими носителями, в качестве которых обычно использовали дифтерийный и столбнячный токсоиды, В-субъединицу экзотоксина А псевдомонад (например, с носителем, имеющим ММ до одного мДа ковалентно сшивали от двух до семи молекул GnRH [59, 71]), масляные, поликатионные адъюванты [3], FSH и LH [53] и др. В 1990-х гг. разработчики вакцин фертильности стали увеличивать плотность антигенных эпитопов путем получения методами генной [19] или белковой инженерии мультимерных (до 12 молекул GnRH) или тандемных форм GnRH. Затем их конъюгировали с высокоиммуногенными носителями [51], либо смешивали с эффективными адъювантами, например, с полным адъювантом Фрейнда [31][2].
Открытие в 1997 г. второй формы GnRH, названной GnRH-II (соответственно, первая его форма, в тех случаях, когда сравнивается их действие, обозначается как GnRH-I), показало, что управление фертильностью со стороны гипоталамуса является значительно более сложным процессом, чем считалось ранее. GnRH-I и GnRH-II синтезируются разными нейронными системами и отличаются друг от друга по антигенным свойствам (рис. 4).
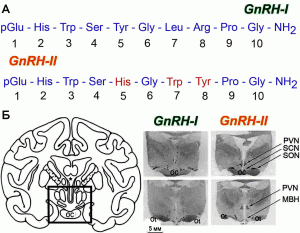 Рис. 4. Молекулярная структура GnRH-I и GnRH-II.
Рис. 4. Молекулярная структура GnRH-I и GnRH-II.
А. Сравнение аминокислотных последовательностей GnRH-I и GnRH-II. Сходство аминокислотных последовательностей 70 %. Б. Слева — квадратом обозначена гипоталамическая область мозга; справа — распределение GnRH-I и GnRH-II мРНК в гипоталамусе макаки-резус. SON — супраоптическое ядро; PVN — паравентрикулярное ядро; SCN — супрахиазматическое ядро; МBH — медиальная часть базального гипоталамуса; OC — зрительный перекрест; Ot — зрительный тракт [76]
Предполагается, что основная роль GnRH-I-нейронов в гаметообразовании заключается в периодической стимуляции синтеза LH (созревание гамет и синтез половых стероидных гормонов), в то время как основная роль GnRH-II-нейронов — преовуляторные выбросы LH [76]. Открытие двух форм GnRH привело к созданию вакцин, представляющих их композиции (GnRH-I/GnRH-II). Такие вакцины разрабатываются для лечения рака простаты у людей и кастрации животных [17].
Однако вакцины, включающие иммуностимулирующие носители и адъюванты, имеют ряд серьезных недостатков, проявляющихся при массовом применении. Адъюванты вызывают образование абсцессов и гранулем, иммуностимулирующие носители — эффект доминирования, когда основной иммунный ответ приходится на них. Кроме того, сам процесс образования конъюгатов GnRH и носителей с использованием карбодиимидной реакции трудно предсказуем по получаемым конечным продуктам. Поэтому в прошлом десятилетии сформировались новые направления конструирования GnRH-вакцин:
введение в антигенную композицию пептидов с эпитопами, распознаваемыми Th-хэлперами — белок F вируса кори, белок CSP возбудителей малярии и др. Такие композиции формировались путем слияния через спейсерную группу пептидов, обладающих выраженными антигенными свойствами, с GnRH [14];
использование в качестве антигена белковых структур рецепторов, специфических для GnRH [8];
использование в качестве антигена слитых с GnRH гликозилированных белков (устранение эффекта доминирования иммуностимулирующего носителя в иммунном ответе на GnRH) [55].
Наиболее типичной для современных GnRH-вакцин является вакцина IMPROVAC®. В России она свободно продается для ветеринарных нужд. По техническому уровню соответствует разработкам второй половины 1980-х гг. Ветеринарные вакцины GonaCon®, Repro-BLOC® отличаются от нее составом адъювантной композиции и схемами применения.
Вакцина IMPROVAC®. Производится Pfizer Inc. В основном используется в свиноводческих хозяйствах для кастрации хряков и получения мяса «без запаха». Одна доза вакцины в качестве действующего вещества содержит 0,4 мг аналога GnRH, конъюгированного с дифтерийным анатоксином, 300 мг ДЭАЭ-декстрана в качестве адъюванта, 0,2 мг тиомерсала в качестве консерванта, мочевину и стерильную воду в качестве вспомогательных веществ. В результате вакцинации в сыворотке крови животного резко понижается уровень тестостерона, LH, FSH, снижается вес и уменьшаются размеры семенников, простаты. Клетки Лейдига[3] пикнотизируются, их количество сокращается. Нарушается сперматогенез (атипичная форма сперматозоидов, утраты головки, дефекты акросомы[4] и др.). Аналогичные данные получены Hilbe M. et al. [18]. На рис. 5 показаны последствия иммунокастрации на примере половой системы хряка.
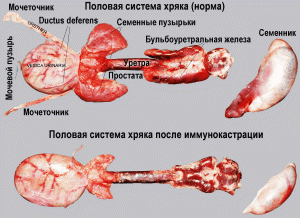 Рис. 5. Половая система хряка до и после иммунокастрации вакциной IMPROVAC®[60]
Рис. 5. Половая система хряка до и после иммунокастрации вакциной IMPROVAC®[60]
Вакцины на основе лютеинизирующего гормона. LH по строению похож на другие гормоны-гликопротеины: тиротропный гормон, HCG, FSH. Его ММ 28,5 кД. Гликопротеин представляет собой димерную структуру, состоящую из двух субъединиц альфа и бета, соединённых двумя дисульфидными мостиками, к каждой из которых присоединены углеводные остатки. Альфа-субъединицы LH, тиротропного гормона, HCG, FSH идентичны, и состоят из 92 аминокислотных остатков. Бета-субъединицы гормонов различаются. Бета-субъединица LH (121 аминокислота) определяет его биологическое действие, специфически взаимодействуя с мембранным рецептором. Она содержит ту же последовательность аминокислот, что и HCG, и стимулирует тот же самый рецептор. Однако HCG имеет 24 дополнительных аминокислоты, и оба гормона существенно отличаются друг от друга своими углеводными компонентами. Различная структура олигосахаридных фрагментов влияет на биологическую активность и скорость разрушения гормонов. Период полураспада LH составляет 20 мин, что короче, чем у FSH (3–4 ч) и HCG (24 ч) [28]. Известно о двух направлениях конструирования вакцин на основе LH: 1) в качестве антигенной детерминанты используется его бета-субъединицы; 2) в качестве антигенной детерминанты используется наружная часть рецептора клеток, специфически взаимодействующего с LH.
Прототипная вакцина создана в средине 1980-х гг. на основе бета-субъединицы LH и полного адъюванта Фрейнда. В опытах на нечеловекообразных приматах было показано ее контрацептивное действие [61]. При вакцинации бычков вакциной на основе конъюгата LH с человеческим сывороточным альбумином достигнуто снижение тестостерона в сыворотке и редукция яичек [21, 57].
Антитела, полученные в результате вакцинации овечьим LH, оказались способными связывать LH приматов (обезьян и людей) и кроликов. При этом количество тестостерона в сыворотке крови через 8–16 нед после вакцинации снижалось на 90%, что приводило к азооспермии[5]. Через 15–18 нед. после вакцинации количество сперматид[6] в популяции (развивающиеся мужские половые клетки в период спермиогенеза) уменьшалось более чем на 90%; сперматоцитов[7] (развивающиеся из сперматогониев[8] мужские половые клетки, предшественники сперматидам) — более чем на 50% [67, 68].
В качестве антигена использовали аминокислотную последовательность рецептора, специфически взаимодействующего с LH на поверхности клетки-мишени. Результаты были получены противоречивые [20, 21]. В последующие годы оба направления конструирования контрацептивных вакцин на основе LH, не получили развития.
Вакцины на основе фолликулостимулирующего гормона. FSH —гликопротеин с ММ около 30 тыс. Д. Его молекула состоит из двух различных по структуре субъединиц (альфа-FSH и бета-FSH), нековалентно связанных друг с другом. Молекулы FSH человека и разных видов животных, обладают значительной гомологией. Бета-цепь специфична для данного гормона, состоит из 118 аминокислотных остатков. Видовых различий в структуре альфа-субъединицы значительно больше, чем в структуре бета-FSH. Углеводная часть FSH составляет около 15% его ММ и характеризуется гетерогенностью. Каждая из субъединиц FSH содержит по две олигосахаридные цепи, соединенные с полипептидной цепью N-гликозидной связью, образуемой остатками N-ацетилглюкозамина и амидной группой остатков аспарагина. Олигосахаридные цепи необходимы для соединения субъединиц и поддержания надлежащей конформации молекулы. Также они защищают полипептидные цепи субъединиц от расщепления протеолитическими ферментами. Специфические биологические свойства FSH обусловлены бета-субъединицей, приобретающей биологическую активность после соединения с альфа-субъединицей.
Большая часть работ по изучению контрацептивной способности вакцин на основе FSH, выполнена с использованием гормона овечьего происхождения. Антитела к овечьему FSH перекрестно реагируют с FSH других видов, в том числе и приматов (обезьяны, человек), но не дают перекрестных реакций с человеческими тиротропным гормоном и LH, имеющим большое сходство по альфа-субъединицам.
Толчком к разработкам вакцин на основе FSH стали исследования, выполненные в 1978–1979 гг. У обезьян, вакцинированных овечьим FSH, обнаружили тестикулярную дисфункцию, хотя никаких изменений в концентрации тестестерона в сыворотке крови не происходило [39, 58]. Конструирование вакцин велось по двум направлениям: 1) повышения иммуногенности FSH или его бета-субъединицы (участка бета-субъединицы, содержащего эпитоп, вызывающий образование антител к рецептору гормона), для чего гормон (бета-субъединицу или ее фрагмент) сорбировали на гидроокиси алюминия, либо сшивали с дифтерийным анатоксином или натрий фтолат производным липополисахарида (sodium pthalate derivative of lipopolysaccharide, SPLPS); 2) получение вакцин на основе аминокислотной последовательностей рецептора (аминокислоты 1–134), специфически взаимодействующего с FSH на поверхности клеток-мишеней.
Сравнительное исследование антигенных свойств интактного FSH и его бета-субъединицы показало, что антитела к FSH обладают на порядок более сильным аффинным сродством, чем антитела к бета-субъединице. Однако Moudgal1 N.R., Jeyakumar M. et al. [37] рекомендовали разработчикам контрацептивных вакцин использовать бета-субъединицу с эффективным адъювантом, а не цельный FSH, так как в этом случае для иммунной системы вакцинированного создается меньшая антигенная нагрузка, обусловленная наличием неспецифических эпитопов у альфа-субъединицы гормона. Специфические антитела, образовавшиеся в результате вакцинации, связывают FSH в сыворотке крови до количеств, не определяемых стандартными иммунологическими методами.
Контрацепция, развивающаяся в результате вакцинации FSH и белком его рецептора, является следствием ухудшения качества спермы вакцинированного. Вакцинация белком рецептора FSH, выполненная в опытах на самцах обезьян, показала, что бесплодие может быть достигнуто без наступления азооспермии. Блокирование рецептора FSH существенно влияет на пролиферацию сперматогоний и продукцию сперматоцитов, но мейоз, этап, на котором происходит образование сперматид, оно не затрагивает. Благодаря значительному уменьшению количества сперматогоний, доступных для мейотического разделения, у вакцинированного значительно уменьшается количество сперматоцитов. В результате у него развивается олигозооспермия[9], но не азооспермия. Лишение тестикул регуляторного воздействия гипоталамуса, осуществляемого посредством FSH, приводит к появлению в эякуляте незрелых сперматозоидов. Аналогичным образом меняется качество спермы после вакцинации FSH (табл. 2).
Таблица 2. Качественные показатели сперматозоидов обезьян, вакцинированных FSH [37]
|
Показатель |
Эффект |
|
Количество в эякуляте |
В 80 % эякулята сокращено на 70% |
|
Жизнеспособность |
Снижена на 50% |
|
Подвижность (gross motility) |
Снижена на 40–50% |
|
Проницаемость через гель |
Снижена на 90% при 15 мм |
|
Активность по акрозину промытых сперматозоидов |
Снижена на 74% |
|
Гиалуронидазная активность промытых сперматозоидов |
Снижена на 34% |
|
Активность циклического АМФ промытых сперматозоидов |
Снижена на 42% |
|
Активность АТФ промытых сперматозоидов |
Повышена до 500% |
|
Связывание с гомологичными ооцитами обезьян |
Заметно ингибирована |
|
Проникновение в zona-denuded яйцеклетки хомяка |
Блокировано |
|
Деконденсация хроматина сперматозоидов |
Высокая чувствительность к дитиотреитолу, индуцированная деконденсацией хроматина |
|
Содержание акросом у сперматозоидов |
Значительно снижено |
В экспериментах по вакцинации добровольцев овечьим FSH, было установлено, что в сыворотке крови не меняется концентрация таких гормонов, как LH, тиреотропный гормон, тестостерон, тироксин, трийодтиронин. FSH (в норме его содержание у мужчин 1–5 нг/мл) может не определяться стандартными иммунологическими методами на пике концентрации специфических антител. Изменения спермы такие же, как у вакцинированных FSH обезьян (см. таблицу 2) [37].
Ни первое, ни второе направление конструирования вакцин контрацепции на основе FSH, не позволили добиться длительного мужского бесплодия. Вакцинация макак-резусов овечьим FSH привела у них к тяжелым нарушениям сперматогенеза в течение 1–2 лет, однако в течение 4,5 лет, несмотря на периодическое повторение вакцинации и олигозооспермию, произошло качественное (но не количественное) восстановление сперматогенеза и фертильности [48, 62]. Причина, почему повторные прививки овечьего FSH не подавили необратимо сперматогенез, осталась неустановленной [34, 35, 37].
При вакцинации рецепторным белком контрацепция оказалась непродолжительной, не более 300 сут, и могла быть достигнута только после двух-трех инъекций антигена с адъювантом. При этом значительно снижалось количество сперматозоидов и их подвижность. Изменение количества тестостерона в сыворотке крови не наблюдалось [35, 38]. Оба направления не получили серьезного развития за последние годы.
В более поздней работе R. K. Naz [41] высказано сомнение в перспективности для медицинской контрацепции всего направления создания контрацептивных вакцин, блокирующих образование гамет, в связи с их выраженным влиянием на продукцию стероидных гормонов. По его мнению, такие вакцины широко будут использоваться только в ветеринарной практике для кастрации животных и в терапевтических целях в клинических ситуациях, требующих ингибирования секреции половых стероидов (миома матки, синдром поликистозных яичников, эндометриоз и преждевременное половое созревание — вакцины на основе GnRH и LH).
Вакцины, нарушающие функции гамет. К ним относятся вакцины, нарушающие присоединение сперматозоида к zona pellucida (ZP) ооцита и блокирующие подвижность и жизнеспособность сперматозоидов.
Вакцины на основе антигенов zona pellucida. ZP (ранее называлась zona striata, в русском языке соответствует термин «блестящая оболочка», используемый редко) — прозрачная эластичная гликопротеиновая оболочка вокруг плазматической мембраны яйцеклетки млекопитающих животных и человека. Ее толщина у человека составляет 5–10 мкм. Через нее свободно проникает вода и растворенные в ней вещества, антитела, ферменты и небольшие вирусы. В индивидуальном развитии яйцеклетки ZP образуется на стадии роста, когда она развивается в составе первичного фолликула. Гликопротеины ZP синтезирует яйцеклетка [79] (рис. 6).
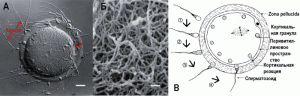 Рис. 6. Яйцеклетка в процессе оплодотворения. А. Сперматозоиды, связанные с ZP яйцеклетки. Масштабная линейка соответствует 13 мкм. Б. Микрофотография ZP яйцеклетки, сделанная сканирующим электронным микроскопом. Масштабная линейка соответствует 200 нм. По [77]. В. Схема, показывающая этапы оплодотворения. 1. Оплодотворение яйцеклетки начинается после связывания интактной акросомы сперматозоида с zona pellucida (ZP3). 2. Связывание сперматозоида с родственным рецептором на ZP3 индуцирует сигнальный трансдукционный каскад (signal transduction cascade), приводящий к акросомальной реакции. 3. Проникновение сперматозоида через матрикс zona pellucida. 4. Яйцеклетка и плазматическая мембрана сперматозоида сливаются, начинается развитие зиготы. Кортикальная реакция, развивающаяся после оплодотворения яйцеклетки, приводит к утрате zona pellucida связывающей активности в отношении сперматозоидов и предотвращает полиспермию [16]
Рис. 6. Яйцеклетка в процессе оплодотворения. А. Сперматозоиды, связанные с ZP яйцеклетки. Масштабная линейка соответствует 13 мкм. Б. Микрофотография ZP яйцеклетки, сделанная сканирующим электронным микроскопом. Масштабная линейка соответствует 200 нм. По [77]. В. Схема, показывающая этапы оплодотворения. 1. Оплодотворение яйцеклетки начинается после связывания интактной акросомы сперматозоида с zona pellucida (ZP3). 2. Связывание сперматозоида с родственным рецептором на ZP3 индуцирует сигнальный трансдукционный каскад (signal transduction cascade), приводящий к акросомальной реакции. 3. Проникновение сперматозоида через матрикс zona pellucida. 4. Яйцеклетка и плазматическая мембрана сперматозоида сливаются, начинается развитие зиготы. Кортикальная реакция, развивающаяся после оплодотворения яйцеклетки, приводит к утрате zona pellucida связывающей активности в отношении сперматозоидов и предотвращает полиспермию [16]
ZP преимущественно формируют три гликопротеина (ZP1, ZP2 и ZP3), показывающие разную подвижность в полиакриламидном гель-электрофорезе, проводимом в присутствии додецилсульфата натрия (sodium dodecyl sulphate–polyacrylamide gel electrophoresis, SDS–PAGE). В составе ZP человека обнаружены четыре гликопротеина: ZP1, ZP2, ZP3 и ZP4. Классификация гликопротеиновых антигенов ZP формировалась применительно к разным объектам исследования, в разное время, и поэтому в литературе встречаются разные наименования одних и тех же антигенов. Наиболее распространена «мышиная» классификация, ее мы используем в данной работе. В табл. 3 приводятся примеры классификаций гликопротеиновых антигенов ZP.
Таблица 3. Классификации гликопротеиновых антигенов ZP [30]
|
Различные млекопитающие* |
Мыши |
Кролики |
Свиньи |
Люди |
|
ZPA |
ZP2 |
rec75 |
ZP1, ZP2, ZP4 |
ZP2 |
|
ZPB |
ZP1 |
rec55 |
ZP3a |
ZPB |
|
ZPC |
ZP3 |
ZPC |
ZP3b |
ZP3 |
* Крупный рогатый скот, кошки, собаки, макаки.
Гликопротеины ZP, выделенные из яйцеклеток различных видов млекопитающих, при сходстве структуры самих полипептидов, имеют различную подвижность в SDS–PAGE, что является следствием их различной посттрансляционной модификации, включающей гликозилирование. Глипротеины ZP яйцеклетки человека (human zona pellucid, hZP) имеют следующую ММ: hZP1 (~100 кДа), hZP2 (~75 кДа), hZP3 (~55 кДа), hZP4 (~65 кДа) [77].
ZP играет основную роль в распознании и связывании сперматозоида с ооцитом, индукции акросомального эндоцитоза в zona-bound сперматозоида и препятствует проникновению более одного сперматозоида в яйцеклетку, т.е. блокирует полиспермию. ZP2 и ZP3 являются лигандами для рецепторов на головке сперматозоидов, ответственных за связывание с zona pellucida и запуск акросомной реакции. ZP3 индуцирует поглощение сперматозоида яйцеклеткой [77].
После проникновения сперматозоида, в яйцеклетке запускается каскад биохимических реакций, приводящий к опорожнению кортикальных везикул — мембранных пузырьков, содержащих литические ферменты. Содержимое кортикальных везикул выбрасывается наружу (в перивителлиновое пространство) и модифицирует zona pellucida таким образом, что последующие сперматозоиды уже не способны проникнуть через нее. Проникновение одного сперматозоида в яйцеклетку — необходимое условие для развития эмбриона [79][10]. Аминокислотные последовательности белков ZP человека и животных, имеют большое сходство между собой (табл. 4).
Таблица 4. Сходство аминокислотных последовательностей белков ZP человека и животных [46]
|
Семейство ZP |
Вид |
Длина полипептидной цепи |
% идентичности с человекам |
|
ZP1 |
Мышь |
622 |
39 |
|
Кролик |
533 |
71 |
|
|
Свинья |
533 |
68 |
|
|
Индийская макака |
539 |
92 |
|
|
Человек |
565 |
– |
|
|
ZP2 |
Мышь |
733 |
60 |
|
Кролик |
672 |
72 |
|
|
Свинья |
716 |
64 |
|
|
Индийская макака |
745 |
94,2 |
|
|
Человек |
745 |
– |
|
|
ZP3 |
Мышь |
424 |
67 |
|
Кролик |
415 |
69 |
|
|
Свинья |
420 |
74 |
|
|
Индийская макака |
424 |
93,9 |
|
|
Человек |
424 |
– |
Представленные в табл. 4 данные объясняют гетероспецифичность антител, образующихся к гликопротеинам ZP разных видов животных и человека. Гликопротеины ZP свиньи (porcine zona pellucida, PZP) обычно используются как антигены выбора для изучения контрацептивного действия таких вакцин у людей и приматов [46]. Сравнительные исследования контрацептивного действия гликопротеинов ZP человека, проведенные на макаках (Macaca fasicularis) и бабуинах (Papio cynocephalus), показали, что наиболее длительную контрацепцию (от 9 до 35 мес) удается достичь при использовании ZP1 в качестве антигенного компонента вакцины [30].
Данное направление конструирования контрацептивных вакцин активно развивалось в 1980-х гг., повторяя те закономерности развития, через которые прошли вакцины, блокирующие образование гамет. В качестве адъювантов использовался полный и неполный адъюванты Фрейнда, сквален, липосомы и др.; в качестве иммуностимулирующего носителя — дифтерийный токсоид. Для получения высокоочищенных препаратов гликопротеинов, гены ZP клонировали в эукариотических и прокариотических организмах, и на их основе получали продуценты отдельных гликопротеинов [1, 15, 19, 46].
Одновременно накапливались сведения о поствакцинальных осложнениях, развивающихся через несколько месяцев после вакцинации гликопротеинами ZP. Схема представлений о процессе оплодотворения яйцеклетки, в соответствии с которой антитела конкурируют со сперматозоидами за специфические участки на поверхности ZP, и тем самыми они блокируют его проникновение в яйцеклетку, не учитывала многие другие варианты событий, вызванные активизацией внутриклеточных сигнальных путей (рис. 7).
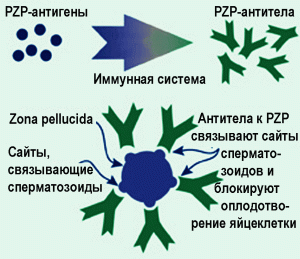 Рис. 7. Схема фармацевтической компании-производителя, иллюстрирующая контрацептивное действие вакцины SpayVac™. Действие антител к ZP объясняется покупателю вакцины с доступных для понимания механических позиций. Однако при взаимодействии антитела с рецептором происходит не только его экранирование от сперматозоидов, но и активизация внутриклеточных сигнальных путей, приводящая к трудно прогнозируемым биологическим эффектам. В данном случае они проявляются дегенеративными изменениями яичников
Рис. 7. Схема фармацевтической компании-производителя, иллюстрирующая контрацептивное действие вакцины SpayVac™. Действие антител к ZP объясняется покупателю вакцины с доступных для понимания механических позиций. Однако при взаимодействии антитела с рецептором происходит не только его экранирование от сперматозоидов, но и активизация внутриклеточных сигнальных путей, приводящая к трудно прогнозируемым биологическим эффектам. В данном случае они проявляются дегенеративными изменениями яичников
В конце 1980-х гг. было установлено, что у макак, вакцинированных ZP3 яйцеклетки свиньи (50 мкг) в полном адъюванте Фрейнда, достигался длительный контрацептивный эффект (не менее 540 сут — срок наблюдения) на фоне высоких титров антител к ZP3, но он сопровождался развитием дегенеративных изменений в яичниках (рис. 8).
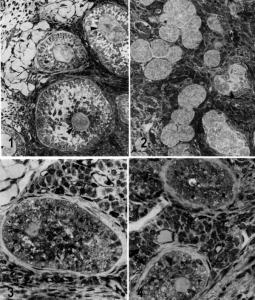 Рис. 8. Дегенеративные изменения яичников индийской макаки, вызванные вакцинацией ZP3 в полном адъюванте Фрейнда. 1. Фолликулы яичников без ооцитов с участками плотного матриксподобного материала. Увеличение в 800 раз. 2. Фолликулярная атрофия. Атрофированные овариальные фолликулы расположены в виде компактных клеточных агрегатов, имеющих вид сот. Стрелкой показан фолликул, подвергшийся резорбции. Увеличение в 1200 раз. 3 и 4. Атрофированные фолликулы, подвергшиеся резорбции. Стрелками показана фиброзная соединительная ткань и гиалиновый материал вокруг фолликул. Увеличение в 1800 раз [13]
Рис. 8. Дегенеративные изменения яичников индийской макаки, вызванные вакцинацией ZP3 в полном адъюванте Фрейнда. 1. Фолликулы яичников без ооцитов с участками плотного матриксподобного материала. Увеличение в 800 раз. 2. Фолликулярная атрофия. Атрофированные овариальные фолликулы расположены в виде компактных клеточных агрегатов, имеющих вид сот. Стрелкой показан фолликул, подвергшийся резорбции. Увеличение в 1200 раз. 3 и 4. Атрофированные фолликулы, подвергшиеся резорбции. Стрелками показана фиброзная соединительная ткань и гиалиновый материал вокруг фолликул. Увеличение в 1800 раз [13]
Гистологическое изучение яичников, извлеченных из животных, вакцинированных ZP3 в полном адъюванте Фрейнда, показало заметное снижение количества фолликул. Яичники в основном содержали первичные фолликулы, расположенные вдоль периферии кортекса. Вторичные фолликулы были значительно меньших размеров, чем в норме. Они выглядели как сотовые агрегаты, связанные через базальную пластинку. Эти остатки фолликулярной ткани находились в процессе рассасывания и были окружены фиброзной соединительной тканью и гиалиновым веществом[11]. Лейкоцитарной инфильтрации, характерной для хронического воспалительного процесса, не было отмечено [13, 75].
Аналогичные результаты в те годы были получены другими исследователями, но у них оставалась надежда на то, что фолликулярные осложнения вызваны либо действием адъюванта, либо наличием примесей других белков, попавших в вакцину вместе с плохо очищенным первичным сырьем, получаемым исследователями на бойне [22, 54]. С целью получения более гомогенных препаратов гликопротеинов ZP использовали технологию рекомбинантной ДНК. Гены ZP клонировали и переносили в специальные клетки-продуценты, полученный продукт тщательно очищали от примесей других белков и конъюгировали с дифтерийным токсоидом. Но результаты оказались разочаровывавшими. Конкуренции со сперматозоидами за специфические участки на поверхности ZP не получилось. Развитие стерильности у вакцинированных собак сопровождалось дегенеративными изменениями яичников [24, 63].
Бабуины (Papio anubis), которым была введена экспериментальная вакцина на основе рекомбинантных обезьяньих (Macaca radiata) ZP1 и ZP2, конъюгированных с дифтерийным токсоидом, остались бесплодными уже после того, как из сыворотки их крови исчезли антитела к этим гликопротеинам. Гистологическое исследование яичников иммунизированных обезьян позволило установить наличие фолликул, подвергшийся обратному развитию или не достигнувших зрелости (atretic follicles), и дегенеративные ооциты, что объясняло бесплодие животных в отсутствие антител, специфических к ZP1 и ZP2 [13].
Из ZP-вакцин наибольшее применение в ветеринарной практике нашли SpayVacTM и IVT-PZP (ImmunoVaccine Technologies™, IVT; Галифакс, Новая Шотландия, Канада). Вакцины предназначены для снижения фертильности диких животных кроме семейства кошачьих. Содержат комплексы гликопротеинов ZP, полученных из яйцеклеток свиней путем водно-тепловой экстракции. В качестве адъюванта преимущественно используется полный адъювант Фрейнда или другие масляные адъюванты. Основное отличие вакцины SpayVacTM от IVT-PZP в том, что у нее антиген включен в липосомы (собственная запатентованная технология). Различаются способы приготовления антигенов, схемы вакцинации и состав адъювантов при первичной и бустерной вакцинациях. Блокируют фертильность животного на период от 22 мес. до 7 лет (в зависимости от вида животного, используемого адъюванта и схемы вакцинации) [33]. По техническому уровню соответствуют разработкам второй половины 1980-х гг. В более поздних патентах на контрацептивные вакцины в качестве антигена ImmunoVaccine Technologies™ защищаются гликопротеины ZP, полученные по технологии рекомбинантной ДНК (например, [9]).
Вакцины, блокирующие подвижность и жизнеспособность сперматозоидов. Это направление конструирования вакцин фертильности появилось в конце 1920-х гг. и с тех пор считается исследователями самым перспективным [40]. Причина такого оптимизма основана на: 1) простоте самой идеи использования белков сперматозоидов в качестве антигенов для вакцинации, как мужчин, так и женщин; 2) результатах ранних экспериментов M.J. Baskin [5, 6], показавшего возможность достижения временного бесплодия у мужчин и женщин, вакцинированных экстрактами спермы; 3) обнаружении антигенных свойств у спермы. Антитела к сперматозоидам обнаруживают у 70% вазэктомизированных[12] мужчин [27] и 2–30% случаев семейного бесплодия, ассоциировано с присутствием антител к сперматозоидам у мужчин и/или женщин [49]. Однако ожидания быстрого успеха в создании универсальной контрацептивной вакцины оказались слишком оптимистичны. В конце 1980-х гг. идентифицировано не более 1 % белков сперматозоидов, и еще меньше было известно о том, какие из них доступны для действия антител [61].
По данным Anil Suri. [2] и Naz R.K. [40, 42, 44], наиболее исследованными антигенами сперматозоидов, рассматриваемых специалистами как антигены для вакцин фертильности, являются следующие:
SPAG9 (sperm associated antigen 9) — белок с ММ 79 кДа. Видимо находится в головке сперматозоида, так как специфическая к нему сыворотка склеивает сперматозоиды «головка к головке». Антитела к этому белку обнаружены у бесплодных женщин с нормальными эндокринными профилями и не имеющих сужения маточных труб. Антитела к SPAG9 перекрестно реагируют со спермой многих видов животных.
PH-20 (PH-20 antigen) — бифункциональный плазмамембранный белок спермы, обладающий гиалуронидазной активностью. Позволяет акросоме сперматозоида пройти через слой клеток вокруг ооцита и благодаря акросомальной реакции связаться с zona pellucidа. Вакцинация морских свинок обоих полов антигеном PH-20 приводила к бесплодию животных. Впоследствии было показано, что у самцов вместе с бесплодием развивался аутоиммунный орхит, проявлявшийся отсутствием сперматозоидов в придатке яичка[13].
SP-10 — акросомальный специфический белок, обнаруженный у сперматозоидов людей, мышей, лис, обезьян (бабуинов и макак), крупного рогатого скота и свиней. Входит в наружный акросомальный комплекс белков. В эксперименте в условиях in vitro антитела к белку SP-10 блокируют проникновение сперматозоидов в яйцеклетку хомяка.
Специфическая лактатдегидрогеназа яичек LDH-C4 (testis specific lactate dehydrogenase LDH-C4) — ферментативно активна тетрамерная форма фермента с ММ 140кДа. LDH-C4 изучается уже более двух десятилетий, и поэтому хорошо охарактеризована. Считается очень перспективным антигеном для вакцин фертильности данного типа. Однако в экспериментах на яванских макаках, когда использовался конъюгат LDH-C4 с участком молекулы столбнячного токсина, включающим эпитоп для Т-клеток, снизить фертильность вакцинированных животных не удалось [74].
MDC-белок (metalloprotease/disintegrin/cysteine-rich protein) —семейство интегральных мембранных белков, включающих различные по первичной структуре металлопротеиназо-подобные домены (metalloproteinase-like domain), также известные как ADAM-семейство белков (ADAM family protein). В фертильности играют роль белки семейства, синтезирующиеся в яичках: фертилин бета (fertilin β, ADAM2), циритестин (cyritestin, ADAM3; tMDC I), ADAM 5 (tMDC II), ADAM 6, ADAM 16 (xMDC 16), ADAM 18 (tMDC III), ADAM 20, ADAM 21, ADAM 24 (testase 1), ADAM 25 (testase 2), ADAM 26 (testase 3), ADAM 29 и ADAM 30. Пять из белков семейства ADAMs (фертилин бета, циритестин, ADAM 5, ADAM 16, ADAM 18) имеют отношение к процессу оплодотворения яйцеклетки и/или созреванию сперматозоидов. Их основная роль в процессе оплодотворения заключается во взаимодействии между плазматическими мембранами сперматозоида и яйцеклетки.
Фертилин бета (fertilin β) — один из первых хорошо охарактеризованных «клеточных дезинтегринов» («cellular disintegrins»). Вызывает слияние сперматозоида и яйцеклетки. Фертилин-бета является одной из субъединиц димеризованного антигена спермы (dimeric sperm antigen), который перекрестно реагирует с одним из антител, ингибирующих фертилизацию, известном как PH-30. Фертилин-бета и циритестин имеют сходные аминокислотные последовательности.
Белок DE (protein DE; acidic epididymal glycoprotein, AEG) — гликопротеин, ММ 37 кДа. В течение эпидидимального созревания (эпидидимальный, т.е. относящийся к придатку яичка) находится в дорсальном регионе головки сперматозоида. Антитела к белку DE/AEG ингибируют его проникновение в свободную зону яйца (zona free egg).
Пептидная последовательность YLP12 (peptide sequence YLP12) — обнаружена в сперме человека и участвует в связывании сперматозоида с яйцеклеткой. Включает 12 аминокислотных последовательностей (YLPVGGLRRIGG). Для исследования контрацептивного эффекта в экспериментах на мышах использовался конъюгат декамера YLP12 с нетоксической В-субъединицей холерного токсина в качестве иммуностимулирующего носителя. Конъюгат вводили экспериментальным животным двумя способами: парентерально и интранозально, другие адъюванты не использовались. Оба способа вакцинации оказались эффективными — в сыворотке крове и слизистой влагалища обнаружены антитела, специфически связывающие сперматозоиды. Фертильность животных оказалась полностью подавленной в течение не менее 305–322 сут. после появления в крови антител к декамеру. Антитела к YLP12 обладали контрацептивным действием. Они блокировали капацитацию[14], акросомальную реакцию и способность сперматозоидов мышей и человека связываться с яйцеклеткой. Пептидные последовательности эпитопов располагались на мембранном белке с ММ 50 кДа, локализованном на акросоме и «хвосте» сперматозоида (рис. 9).
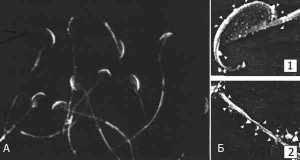 Рис. 9. Взаимодействие YLP12-антител со сперматозоидами человека. А. Изображение, полученное с помощью непрямой иммунофлюоресценции. Увеличение в 650 раз. Б. Изображение, полученное с помощью иммуносканирующей электронной микроскопии. Увеличение в 10 тыс. раз Антитела взаимодействуют с акросомой (Б.1) и «хвостом» сперматозоида (Б.2). Для контрастирования используются частицы золота (показаны стрелками) [45]
Рис. 9. Взаимодействие YLP12-антител со сперматозоидами человека. А. Изображение, полученное с помощью непрямой иммунофлюоресценции. Увеличение в 650 раз. Б. Изображение, полученное с помощью иммуносканирующей электронной микроскопии. Увеличение в 10 тыс. раз Антитела взаимодействуют с акросомой (Б.1) и «хвостом» сперматозоида (Б.2). Для контрастирования используются частицы золота (показаны стрелками) [45]
Большинство исследований по вакцинации антигенами сперматозоидов выполнено на мышах. И ни одно из них не дало 100 % блокирования фертильности. Максимальное снижение фертильности не превышало в 75%. Существует проблема сопоставимости результатов, полученных на разных экспериментальных моделях. Яичники самок мышей за время одного цикла овуляции производят приблизительно от 20–50 ооцитов. У женщин, как правило, созревает одна яйцеклетка на цикл. Следовательно, нет никакой уверенности в том, что достигнутое в экспериментах на мышах снижение фертильности удастся воспроизвести у людей [42].
Для повышения эффективности вакцин, блокирующих подвижность и жизнеспособность сперматозоидов, в последнее десятилетие сформировались два новых направления: 1) повышение мультиэпитопности вакцины, т.е. в качестве антигенов в вакцине используют несколько антигенов сперматозоидов [43]. Появление данного направления свидетельствует об исчерпании возможностей дальнейшего наращивания антигенности моновакцин данного типа путем введения в их состав сильных адъювантов или конъюгирования антигена с иммуностимулирующим носителем; 2) перенесения направления поисков со специфических антигенов сперматозоидов, на их уникальные поверхностные структуры, участвующие в биоэнергетических процессах (превращение АТФ в цАМФ, фосфорилирование белков и др.), и обеспечивающих реализацию физиологических функций клеток, в частности, на ионные каналы CatSper, избирательно проницаемые для ионов кальция [10, 47].
Вакцины, нарушающие формирование зародыша и его имплантацию в матку. Вакцины фертильности выше описанных типов (ориентированные на блокирование образования гамет и нарушающие их функцию) создают условия, препятствующие оплодотворению яйцеклетки и превращению ее в зиготу[15]. Однако уже более 40 лет идет разработка вакцин с принципиально иным механизмом снижения фертильности людей — вызывающих прерывание уже развившейся беременности, т.е. аборт. Мишенью разработчиков таких вакцин стали процессы формирования зародыша и имплантации его в матку.
В предимплантационном развитии зародыша зигота, сформировавшаяся после оплодотворения яйцеклетки, выполняет серию делений и дифференциаций клеточной структуры (образование морулы, бластулы), в результате чего образуется бластоциста[16] — шар, состоящий из нескольких сотен клеток. Размер бластоцисты у человека 0,1 мм. Бластоциста состоит из двух клеточных популяций: трофобласта (трофэктодермы) и эмбриобласта (внутренней клеточной массы). Трофобласт формирует внешний слой эмбриона — полый шар или пузырёк. Эмбриобласт формирует внутренний слой бластоцисты, располагается внутри трофобластатического пузырька в виде скопления клеток у одного из полюсов шара (внутренняя клеточная масса). Трофобласт участвует в имплантации (прикрепление эмбриона к эпителию матки, инвазия внутрь эндометрия матки, иммуносупрессорное действие, разрушение кровеносных сосудов), а также в формировании эктодермы ворсинок хориона (эктодермальная часть плаценты). Эмбриобласт даёт начало телу плода, а также мезодермальным и эктодермальным структурам внезародышевых органов (желточному мешку, аллантоису, амниону, мезодермальной части хориона) [7].
В формировании зародыша и имплантации его в матку участвуют не менее 76 цитокинов, хемокинов, факторов роста, интегринов и других факторов белковой и гликопротеиновой природы (таблица 5). Lemons A.R., Naz R.K. [26] распределили их на пять групп, в зависимости от стадии беременности (рис. 10).
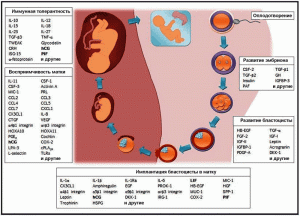 Рис. 10. Схематическое изображение этапов формирования зародыша и имплантации его в матку. Жирным шрифтом выделены факторы белковой природы, регулирующие развитие беременности, рассматриваемые специалистами в качестве перспективных антигенов для конструирования контрацептивных вакцин [26].
Рис. 10. Схематическое изображение этапов формирования зародыша и имплантации его в матку. Жирным шрифтом выделены факторы белковой природы, регулирующие развитие беременности, рассматриваемые специалистами в качестве перспективных антигенов для конструирования контрацептивных вакцин [26].
Наибольшие усилия разработчиков вакцин фертильности, вызывающих прерывание беременности, были сосредоточены на вакцине, использующей в качестве антигенного компонента HCG. Данное направление развивается с начала 1970-х гг. [36, 69].
Таблица 5. Цитокины, хемокины и другие факторы, регулирующие развитие беременности [26]
|
Белок
|
ММ, кДа |
Ген человека |
Роль в развитии беременности | |
|
Интерлейкины |
IL-1альфа |
18 |
IL1A |
Вызывает изменения в адгезии и инвазии |
|
IL-1бета |
17,5 |
IL1B |
Тоже + стимуляция продукции IL8 |
|
|
IL-1 рецептор антагонист (IL-1Ra) |
17,0 |
lL1RN |
Предотвращает адгезию |
|
|
IL-6 |
26 |
IL6 |
Стимулирует секрецию лептина и металлопротеазную активность |
|
|
IL-10 |
18 |
IL10 |
Снижает цитотоксическую активацию uNK-клеток |
|
|
IL-11 |
23 |
IL11 |
Запускает развитие децидуальной ткани (отпадающей оболочкой матки) |
|
|
IL-12 |
75 |
IL12A/IL12B |
Иммуномодуляция |
|
|
IL-15 |
18 |
IL15 |
Регулирует экспрессию IL-8 и uNK-клеток |
|
|
IL-18 |
18 |
IL18 |
Увеличивает экспрессию перфорина и цитолитический потенциал uNK-клеток |
|
|
IL-23 |
21 |
IL23A/IL12B |
Иммуномодулятор, регулирует экспрессию IL-8 |
|
|
IL-27 |
27 |
EBI3/IL30 |
Иммуномодулятор |
|
|
Фактор ингибирования лейкемии (LIF) |
26 |
LIF |
Регулирует экспрессию генов, важных для имплантации эмбриона (бластоцисты) |
|
|
Колониестимулирующие факторы |
Гранулоцитарный колониестимулирующий фактор (G-CSF) |
19 |
CSF3 |
Рекрутирует макрофаги в матку, что бы подготовить ее для имплантации эмбриона |
|
Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) |
14,4 |
CSF2 |
Усиливает пролиферацию и жизнеспособность бластомеров |
|
|
Макрофагальный колониестимулирующий фактор (M-CSF) |
36 |
CSF1 |
Рекрутирует макрофаги в матку, что бы подготовить ее для имплантации эмбриона |
|
|
Суперсемейство трансформирующий факторов роста бета (TGFβ Superfamily) |
Активин А (Activin A) |
24–28 |
INHBA |
Способствует развитию децидуальной оболочки; предотвращает активацию Т-клеток |
|
Макрофагингибирующий цитокин (MIC-1) |
25 |
GDF15 |
Регулирует миграцию / инвазию трофобластов и децидуализацию |
|
|
Трансформирующий фактор роста β1 (TGFβ1) |
25 |
TGFB1 |
Регулирует развитие эмбриона |
|
|
Трансформирующий фактор роста β2 (TGFβ2) |
25 |
TGFB2 |
То же |
|
|
Трансформирующие факторы роста β3 (TGFβ3) |
25 |
TGFB3 |
Регулирует Т-клеточные ответы |
|
|
Семейство факторов некроза опухолей (TNF Family) |
Фактор некроза опухолей α (TNFα) |
25 |
TNF |
Иммуномодулирующее действие. Высокий уровень TNFα приводить к токсическому эффекту |
|
Фактор некроза опухолей, слабый индуктор апоптоза (TWEAK) |
17 |
TWEAK |
Контроль цитотоксичности, возможно через IL-15 и IL-18 |
|
|
Гормоны |
Гормон роста (GH) |
22 |
GH1/GH2 |
Способствует нормальному развитию эмбриона |
|
Пролактин (PRL) |
24 |
PRL |
Способствует развитию децидуальной оболочки |
|
|
Хемокины |
CCL-2 (MCP-1) |
11 |
CCL2 |
Рекрутирует в эндометрий моноциты, макрофаги и Т-клетки |
|
CCL-3 (MIP1α) |
7,9 |
CCL3 |
Рекрутирует макрофаги |
|
|
CCL-4 (MIP-1β) |
7,62 |
CCL4 |
Рекрутирует макрофаги и NK-клетки, способствует миграции трофобласта |
|
|
CCL5 (RANTES) |
8 |
CCL5 |
Рекрутирует макрофаги и NK-клетки. Снижает их количество, когда это необходимо для имплантации эмбриона |
|
|
CCL-7 (MCP-3) |
8,5 |
CCL7 |
Рекрутирует макрофаги и NK-клетки, либо подавляет их при имплантации эмбриона |
|
|
CXCL1 (GRO1; KC) |
11 |
CXCL2 |
Тормозит воспалительный ответ |
|
|
IL-8 (CXCL8) |
8,5 |
IL8 |
Регулирует экспрессию генов воспалительного ответа |
|
|
CX3CL1 (fractalkine) |
90 |
CX3CL1 |
Рекрутирует макрофаги и НК-клетки, способствует миграции трофобласта, регулирует экспрессию генов адгезии |
|
|
Семейство факторов эпидермального роста (EGF family) |
Амфирегуллин (AREG) |
9.5–16.5 |
AREG |
Регулируется через LIF, необходим для имплантации эмбриона |
|
Эпидермальный фактор роста (EGF) |
6 |
EGF |
Стимулируем миграцию/инвазию трофобласта внутрь эндометрия матки |
|
|
Гепаринсвязывающей EGF-подобного фактора роста (HB-EGF) |
22 |
HB-EGF |
Регулируется через LIF; способствует развитию бластоцисты |
|
|
Трансформирующий фактор роста α (TGFα) |
17 |
TGFA |
Увеличивает скорость расширения бластоцели |
|
|
Факторы роста |
Acrogranin/progranulin |
68 |
GRN |
Способствует адгезии, росту и дифференциации бластоцисты |
|
Основной фактор роста фибробластов (FGF2, bFGF) |
18–22 |
FGF2 |
Готовит бластоцисту к перемещению к эпителию матки |
|
|
фактор роста соединительной ткани (CTGF) |
38 |
CTGF |
Регулирует функцию матки |
|
|
фактор роста гепатоцитов (HGF) |
78 |
HGF |
Регулирует дифференцировку цитотрофобласта и глубину инвазии вовнутрь эндометрия матки |
|
|
фактор роста тромбоцитов (PDGF-A) |
16 |
PDGFA |
Способствует росту трофобласта |
|
|
Prokineticin 1 (PROK1) |
9,5 |
EGVEGF |
Вызывает экспрессию генов, отвечающих за имплантацию эмбриона (т.е. LIF) |
|
|
Фактор роста эндотелия сосудов (VEGFA |
45 |
VEGFA |
Поддерживает corpus luteum (желтое тело) |
|
|
Интегрины |
α4β1 |
280 |
ITGA4/ITGB1 |
Важен для имплантации эмбриона в матку и развития децидуальной оболочки |
|
α5β1 |
265 |
ITGA5/ITGB1 |
Имеет важное значение для миграции вне ворсинчатых трофобластов (IFG-I—индуцированной) |
|
|
α9β1 |
230 |
ITGA9/ITGB1 |
Важен для имплантации эмбриона в матку |
|
|
αvβ3 |
230 |
ITGAV/ITGB3 |
Участвует в EVT миграции, важен для имплантации эмбриона в матку и развития децидуальной оболочки |
|
|
Другие факторы |
Адреномедуллин |
6 |
ADM |
Участвует в инвазии и в формировании pinopode |
|
α-фетопротеин |
70 |
AFP |
Блокирует иммунный ответ |
|
|
Cochlin (COCH) |
60 |
COCH |
Маркер восприимчивости матки |
|
|
Кортикотропин-рилизинг-гормон (CRH) |
5 |
CRH |
Способствует имплантации эмбриона через регуляцию экспресии FasL |
|
|
Циклооксигеназа-2 (COX-2) |
72 |
PTGS2 |
Участвует в синтезе простагландинов. Необходима для оплодотворения, имплантации эмбриона в матку и развития децидуальной оболочки |
|
|
Цитоплазматическая фосфолипаза A2α (cPLA2α) |
85 |
cPLA2α |
Участвует в синтезе арахидоновой кислоты, необходимой для имплантации эмбриона в матку |
|
|
Dickkopf-1 (DKK-1) |
25 |
DKK1 |
Необходим для роста и адгезии бластоцисты |
|
|
Гликоделин |
28 |
PAEP |
Участвует в связывании сперматозоида с ооцитом и предотвращает развитие воспалительного ответа |
|
|
Гепарансульфатпротеогликан (HSPG) |
500 |
Нет данных |
Участвует в имплантации бластоциты к стенке матки |
|
|
Человеческий хорионический гонадотропин (hCG) |
37,6 |
CGB |
Очень широкий спектр действия, среди них лютеинизирующая и фолликулостимулирующая активности. См. в тексте статьи |
|
|
Homebox A10 (HOXA-10) |
40 |
HOXA10 |
Необходим для развития децидуальной оболочек и имплантации эмбриона в матку |
|
|
Homebox A11 (HOXA-11) |
35 |
HOXA11 |
Необходим для дифференциации стромальных и железистых клеток матки |
|
|
Immunoresponsive gene 1 homolog (IRG1) |
52 |
IRG1 |
Необходим для имплантации эмбриона в матку |
|
|
Инсулин |
5,8 |
INS |
Усиливает клеточную дифференциацию на ранней стадии эмбриогенеза |
|
|
Инсулин-подобный фактор роста I (IGF-I) |
7,65 |
IGF1 |
Способствует клеточному росту зародыша |
|
|
Инсулин-подобный фактор роста II (IGF-II) |
7,5 |
IGF2 |
Участвует в созревании яйцеклетки и развитие эмбриона в стадии бластоцисты |
|
|
Инсулиноподобный фактор роста-связывающий белок 1 (IGFBP-1) |
25 |
IGFBP1 |
Ограничивает рост трофобластов и ингибирует IGF-I активность |
|
|
Инсулиноподобный фактор роста, связывающий белок 2 (IGFBP-3) |
40 |
IGFBP3 |
Участвует в созревании яйцеклетки и развитии зародыша |
|
|
Индуцируемый интерфероном 17 кДа белок (ISG15) |
17 |
ISG15 |
Возможно иммуномодулирующее действие. Появляется в эндометрии в ответ на имплантацию эмбриона |
|
|
Лептин |
16 |
LEP |
Участвует в развитии бластоцисты; опосредует инвазивность цитотрофобласта |
|
|
Рецептор лизофосфатидной кислоты 3 (LPA3) |
40 |
LPAR3 |
Регулирует восприимчивость матки к имплантации эмбриона |
|
|
L-селектин |
43 |
SELL |
То же |
|
|
Муцин 1 (MUC-1) |
300 |
MUC1 |
Вовлечен в процесс присоединения эмбриона к эпителию матки |
|
|
Специфический гликопротеин фаллопиевой трубы (OVGP1; MUC-9) |
120 |
OVGP1 |
Усиливает сцепление сперматозоида с zona pellucida яйцеклетки |
|
|
Фактор активации тромбоцитов (PAF) |
524 |
Нет данных |
Стимулирует раннее эмбриональное развитие |
|
|
Преимплантационный фактор (PIF) |
0,6–1,8 |
Нет данных |
Регулирует иммунитет, способствует адгезии и инвазии бластоцисты, а также регулирует процессы апоптоза |
|
|
Простагландин E2 (PGE2) |
352 |
Нет данных |
Участвует в воспалительной реакции в эндометрии необходимой для имплантация эмбриона |
|
|
Секретируемый фосфопротеин 1 (SPP1) |
44 |
SPP1 |
Необходим для имплантации эмбриона |
|
|
Трофинин |
69 |
TRO |
Участвует в активации трофэктодермы для адгезии |
|
Молекулу HCG формируют 237 аминокислот, ММ 36,7 кДа. По химическому строению он является гликопротеином. Альфа-субъединица HCG полностью гомологична альфа-субъединицам FSH, LH и тиреотропного гормона. Бета-субъединица HCG уникальна именно для него. Поэтому все усилия создать контрацептивные вакцины на основе HCG сосредоточены на бета-субъединице HCG. Роль HCG в развитии беременности показана на рис. 11.
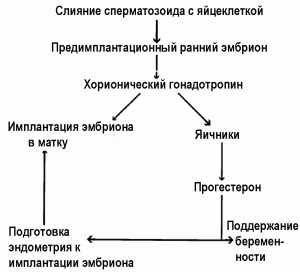 Рис. 11. Роль HCG в развитии беременности. Антитела к HCG предотвращают имплантацию эмбриона в матку [70]
Рис. 11. Роль HCG в развитии беременности. Антитела к HCG предотвращают имплантацию эмбриона в матку [70]
Конструирование контрацептивных вакцин на основе HCG началось с работ Talwar et al. [72] и Stevens et al. [65, 66]. Первая группа исследователей использовала в качестве антигена целую бета-субъединицу HCG (бета-HCG-вакцина), вторая (пользовавшаяся поддержкой ВОЗ) — ее усеченный вариант (CTP-вакцина; carboxy terminal peptide), соответствующий 37 аминокислотным последовательностям от карбоксильного конца бета-HCG. ММ такого CTP-фрагмента HCG 3 тыс. кДа. Необходимость использования CTP обосновывалось наличием общих участков в первичной структуре HCG и LH. Разработчики вакцин опасались, что антитела к HCG будут блокировать функцию LH (см. выше), 33 аминокислотные последовательности со стороны С-конца HCG не имели сходства с LH. Первую фазу клинических исследований[17] CTP-вакцина прошла в конце 1990-х гг. За шесть месяцев наблюдения над вакцинированными женщинами не было выявлено никаких осложнений [23, 64].
Еще одним подходом к снижению антигенного сходство между бета-субъединицами HCG и LH, было частичное нарушение конформации бета-субъединицы HCG. Для этого рассекались и алкилировались три внутрицепочечные дисульфидные группы и полученное производное бета-субъединицы сшивали с иммуностимлирующим носителем. Антигенные свойства HCG снижались, но антигенное сходство с LH утрачивалось полностью. При рассечении всех шести внутрицепочечных дисульфидных связей, антигенные свойства HCG утрачивались [4]. Данное направление конструирования HCG-вакцин дальнейшего развития не получило.
Бета-субьединица HCG и ее CTP-производные (впоследствии были использованы фрагменты протяженностью в 45 и 53 аминокислоты [70]) оказались слабыми антигенами. Поэтому их сшивали с дифтерийным (DT) и столбнячным (TT) токсоидами и добавляли к адъюванту. Среди иммунотимулирующих носителей наибольшим предпочтением у исследователей пользовался нативный столбнячный токсоид, так как эти вакцины предполагалась использовать и для профилактики столбняка в Индии, где он тогда был широко распространен среди женщин и новорожденных детей. CTP-вакцины использовали вместе с сильными адъювантами (адъювант Фрейнда, сквален, Arlacel A) [70].
Значительно большую антигенную активность, чем CTP-вакцины, показали вакцины, включающие целый бета-HCG, сшитый со столбнячным токсоидом и сорбированный на гидроокиси алюминия. Авидность антител к рецептору HCG, вырабатывавшихся в ответ на введения такой вакцины, была на порядок выше, чем у антител, образовавшихся после введения CTP-вакцины [70]. Первая фаза клинических исследований бета-HCG-вакцины проведена в конце 1990-х гг. в Финляндии, Швеции, Чили и Бразилии под патронажем «International Committee on Contraception Research of the Population Council». У вакцинированных женщин сохранялся регулярный менструальный цикл и овуляция. Отклонений со стороны гормональных и гематологических показателей не отмечено. В тоже время выявился серьезный недостаток таких вакцин — большая разница в титрах антител к HCG у вакцинированных, что предполагает вариабельность результатов при массовых вакцинациях [70].
Неудача бета-HCG-вакцины послужила толчком к поиску путей повышения антигенных свойств бета-субъединицы HCG. Эффективным подходом к решению данной задачи стало получение гибридного HCG, состоящего из бета-субъединицы HCG и альфа-субъединицы хорионического гонадотропина овечьего происхождения. Гибрид сшивали со столбнячным токсоидом и сорбировали на гидроокиси алюминия [73]. Вакцина получила обозначение HSD, т.е. гетероспецифический димер (heterospecies dimer). В понимании ее разработчиков вакцинация дала хорошие результаты. Титр антител, препятствующий развитию беременности, сохранялся после каждой бустерной вакцинации в среднем 3 месяца (от 6 недель до 6 месяцев). Женщины восстанавливали фертильность после того как концентрация антител к HCG в сыворотке крови падала ниже 35 нг/мл. Вакцинация женщин обеими, бета-HCG–TT и HSD–TT/DT-вакцинами, приводила к образованию антител, перекрестно реагирующих с человеческим LH. Однако осложнений, связанных с блокирование LH (см. выше), во время второй фазы клинических исследований[18], проведенных в Индии в конце 1990-х гг., обнаружено не было. HSD-вакцина считалась в то время лучшей из трех исследованных (CTP-вакцина, бета-HCG-вакцина, HSD-вакцина) [69, 70, 72].
Однако до настоящего времени контрацептивные вакцины на основе HCG в коммерческую реализацию не поступили. Naz R.K. [41] объясняет это невозможностью достичь высоких тиров антител. Но и высокие титры антител к HCG, когда их удается создать, не решают проблему коммерческой непригодности вакцины. В описании к патенту, опубликованному позже завершения второй фазы клинических испытаний такой вакцины в Индии, утверждается, что при высоких титрах антител к HCG они блокируют LH и вызывают образование иммунных комплексов со всеми последующими осложнениями. Сами авторы предлагали контрацептивную вакцину на основе рецептора к HCG [56], но в последующие годы это направление не получило развития, видимо из-за его сложности.
Признаки скрытого применения вакцин контрацепции. Сообщения о скрытых массовых вакцинациях контрацептивными вакцинами приходили из Пакистана [78], Индонезии и стран Латинской Америки [12].
Российское законодательство в области контроля качества иммунобиологических лекарственных препаратов (ИЛП) построено так, что контролирующая организация на этапе доклинического исследования проверяет препарат по показателям, определенным самим производителем. Качество лекарственного средства — соответствие лекарственного средства требованиям фармакопейной статьи либо в случае ее отсутствия нормативной документации или нормативного документа[19]. Поэтому искать стерилизующий компонент в вакцине никто не будет, если он не заявлен в нормативном документе как один из показателей ее качества (!). Закупки вакцин для массового применения осуществляются по тендеру. Его выигрывает поставщик, предложивший лучшие условия покупателю. Но заподозрить такую вакцинацию все же можно на основании следующих косвенных признаков:
1) навязываемые населению репродуктивного возраста под явно надуманными предлогами частые вакцинации и ревакцинации. Антигены, используемые в контрацептивных вакцинах, не дают высоких титров специфических антител на период времени более 1,5–2 лет. Если в этот промежуток времени не произойдет поражения специфическими антителами органов репродуктивной системы (характерно для вакцин, использующих в качестве антигенов GnRH, LH, FSH, ZP), то фертильность человека восстанавливается. Что бы этого избежать, под предлогом вакцинации от столбняка, женщинам в Никарагуа, на Филиппинах и в Мексике трижды, с промежутками в несколько месяцев, вводили вакцину с HCG, конъюгированным со столбнячным анатоксином. Наличие HCG в вакцине подтверждено лабораторными методами исследования. Для реальной профилактики заболевания столбняком введение противостолбнячной вакцины пациенту делается однократно, с временным интервалом не менее 10 лет [12];
2) знать того, кто стоит за вакцинацией, кто ее инициатор, кто реальный производитель вакцин и состояние его производственных мощностей. Если вакцинацией занимается какая-то неправительственная западная организация, вакцина предлагается бесплатно, в рамках гуманитарной помощи и т.п., то это уже должно настораживать вакцинируемых, так как бесплатных вакцин не бывает, их производство и реализация — весьма прибыльный бизнес; а сама организация-гуманист может оказаться частью сетевой структуры, контролируемой правительством, нежелающим огласки.
Прямые доказательства скрытого использования контрацептивных вакцин можно получить путем исследования состава вакцин, используемых для массовых вакцинаций населения и обнаружения в них незаявленных производителем антигенных компонентов, включаемых только в контрацептивные вакцины (см. таблицу 1). Не обязательно, что такие вакцины поступят на рынок в результате саботажа. Возможна халатность или беспринципность, когда дешевая основа вакцины, предназначенной для кастрации хряков, будет продана производителю как основа для дифтерийных и столбнячных вакцин медицинского применения.
Уже осуществленное скрытое применение вакцин контрацепции можно предположить по совокупности следующих признаков: 1) наличие в сыворотке крови вакцинированного пациента антител к антигенным компонентам, используемым только в контрацептивных вакцинах (см. таблицу 1; в норме в сыворотке людей антител к таким антигенам не бывает за исключением случаев, связанных с бесплодием); 2) изменение гормонального фона вакцинированного пациента; 3) нарушения функционирования и патогистологические изменения в органах репродуктивной системы пациента, развившиеся в течение 3-х и более месяцев после вакцинации (табл. 6).
Таблица 6. Признаки осуществленного скрытого применения вакцин контрацепции
|
Антиген/мишень |
Длительность циркулирования специфических антител |
Изменения гормонального фона |
Патогистологические изменения в органах репродуктивной системы |
Изменения в функционировании репродуктивной системы |
Примечание |
|
GnRH/мужская часть населения |
До полугода |
В сыворотке крови вакцинированного в течение нескольких недель значительно понижается уровень тестостерона, LH, FSH |
Пикнотизируются клетки Лейдига, их количество сокращается, атипичная форма сперматозоидов (утраты головки, дефекты акросомы и др., см. таблицу 2) |
Снижается вес и уменьшаются размеры семенников, простаты, нарушается сперматогенез, развивается импотенция |
Такие вакцины могут появиться на рынке под видом дифтерийных и столбнячных путем подмены основы компонентами для производства ветеринарных вакцин типа IMPROVAC® |
|
LH/мужская часть населения |
То же |
В сыворотке крови вакцинированного в течение нескольких недель значительно понижается уровень тестостерона |
Уменьшение в семенных канальцах тестикул количества сперматид и сперматоцитов, редукция яичек |
Азооспермия, импотенция |
LH не имеет строгой видоспецифичности |
|
FSH/мужская часть населения |
До 2 лет |
Концентрация в сыворотке крови LH, тиреотропного гормона, тестостерона, тироксина, трийодтиронина остается в норме. FSH не обнаруживается |
Снижение пролиферации сперматогоний и продукции сперматоцитов |
Ухудшение качественных показателей спермы (см. табл. 2), олигозооспермия, появление в эякуляте незрелых сперматозоидов, импотенция |
То же |
|
ZP/женская часть населения |
До 2-х лет |
Непоказательные изменения |
Дегенеративные изменения яичников |
Оофарит, нарушение менструального цикла |
См. примечание для GnRH. Бесплодие может сохраниться и после исчезновения антител из сыворотки крови |
|
PH-20/мужская часть населения |
Нет данных |
То же |
Воспалительные изменения в тестикулах |
Аутоиммунный орхит, отсутствие сперматозоидов в придатке яичка |
– |
|
HCG/женская часть населения |
До полугода |
То же |
Нет данных |
Нет данных |
Имеется информация об использовании противостолбнячных вакцин с конъюгированным HCG для стерилизации женщин в странах третьего мира |
*Интерпретация приведенных в таблице данных может осуществляться только специалистами с учетом анамнеза и наследственности пациента.
***
Сообщения о скрытых массовых вакцинациях контрацептивными вакцинами не являются домыслами «антивакцинаторов» и «исламских фанатиков». Упомянутая в известной книге F. Engdahl [12] вакцинация населения стран Третьего мира осуществлялась вакциной, содержащей в качестве антигена HCG. Но это только одно и не самое опасное направление их конструирования, о чем автор не догадывается. Всего на сегодняшний день развиваются три принципиально различающиеся направления создания вакцин фертильности, а в их рамках разрабатывается не менее 12 частных подходов к конструированию таких вакцин. Для проведения массовых вакцинаций населения вакцинами фертильности, у сетевых организаций имеются огромные ресурсы: научные — знания тонких механизмов регуляции фертильности человека; организационные — разветвленная сеть фондов и неправительственных организаций; правовые — «подогнанная» под интересы транснациональных фармацевтических корпораций законодательная база в области оборота лекарственных средств; информационные и коррупционные — примером их объединения можно считать настойчивое нагнетание СМИ атмосферы страха перед псевдопандемиями свиного и птичьего гриппов. Открыто существует и идеологическая база, обосновывающая необходимость массового сокращения населения — неомальтузианство. ВОЗ не является организацией с безукоризненной репутацией. Вакцинация «HCG+столбняк» в странах Третьего мира проводилась под эгидой этой организации.
Отказаться от такого мощного средства специфической профилактики инфекционных болезней, как вакцинация, нельзя. Тем самым будут созданы условия для массового распространения инфекционных болезней, сегодня контролируемых вакцинацией. Но и игнорировать возможность использования массовых вакцинаций для скрытой стерилизации населения, значит перестать защищать себя и будущее своих детей и внуков. Необходимо серьезно переосмыслить подходы к доклиническому исследованию ИЛП и восстановить государственный контроль над их производством, существовавший в советское время. Целесообразно запретить ввоз в Россию контрацептивных вакцин ветеринарного назначения, если они используют в качестве иммуностимулирующего носителя антигены, используемые в вакцинах медицинского назначения.
Литература
1. Aitken R.J., Rudak E.A., Richardson D.W., Dor J. et al. The influence of anti-zona and anti-sperm antibodies on sperm-egg interactions // J. Reprod. Fert. 1981. V. 62. P. 597–606.
2. Anil Suri. Sperm specific proteins-potential candidate molecules for fertility control // Reproduc. Biol. Endocrin. 2004. V. 2 (электронный ресурс: http://www.rbej.com/content/2/1/10).
3. Anthony M.B., Roger A., Bulter C. WO 91/04052. Vaccines // Peptide Technology Ltd. [Австралия]. Заявл.22.09.1989; опубл. 04.04.1991.
4. Bahl O.P. GB2051081. Antigen for early pregnancy test and contraceptive vaccine // Research Corp. [США]. Заявл. 06.02.1978; опубл. 14.01.1981.
5. Baskin M.J. Temporary sterilization by injection of human spermatozoa: a preliminary report // Am. J. Obstet. Gynecol. 1932. V. 24. P. 892–897.
6. Baskin M.J. US2103240. Nonspecific spermatoxic vaccine and process of producing same / США. Заявл.07.08.1935; опубл. 28.12.1937.
7. Blastocyst. Электронный ресурс http://en.wikipedia.org/wiki/Blastocyst.
8. Bowen R.L. NZ533463 (A). Methods for slowing senescence and treating and preventing diseases associated with senescence / Voyager Pharmaceutical Corp [США]. Заявл. 19.12.2002; опубл. 23.02.2007.
9. Brown R., G. Mansour M., Pohajdak B. EP1474447 (A2). Antigens for immunocontraception // Immunovaccine Technologies Inc. [Канада]. Заявл. 08.02.2002; опубл. 10.11.2004.
10. Calcium channel. Электронный ресурс http://en.wikipedia.org/wiki/Calcium_channel.
11. Edwards R.G. Immunological control of fertility in female mice // Nature. 1964. V. 203. P. 50–53.
12. Engdahl F. Seeds of Destruction. The Hidden Agenda of Genetic Manipulation. Centre for Research on Globalization Publishing. 2007.
13. Govind C.K., Gupta S.K. Failure of female baboons (Papio anubis) to conceive following immunization with recombinant non-human primate zona pellucida glycoprotein-B expressed in Escherichia coli // Vaccine. 2000. V. 18. P. 2970–2978.
14. Grimes S., Dov M., Vernon S. US2005112721 (A1) Chimeric peptide immunogens // Grimes S., Dov M., Vernon S. [США]. Заявл. 05.05.2000; опубл. 26.05.2005.
15. Gupta J.C., Raina K., Talwar G.P. et al. Engineering, cloning and expression of genes encoding the multimeric luteinising- hormone-releasing-hormone linked to T-cell determinants in Escherichia coli // Protein. Express. Purif. 2004. V. 37. P. 1–7.
16. Gupta S.K., Jethanandani P., Afzalpurkar A., Kaul R. et al. Prospects of zona pellucida glycoproteins as immunogens for contraceptive vaccine // Human Reproduction Update. 1997. V 3. № 4. P. 311–324.
17. Hans M.R., Berendina O.H. US20040166118. Peptide, immunogenic composition and vaccine or medical preparation, a method to immunize animals against the hormone LHRH, and analogs of the LHRH tandem repeat peptide and their use as vaccine // Hans M.R., Berendina O.H., Pepscan Systems B.V [Нидерланды]. Заявл. 07.06.1995; опубл. 26.08.2004.
18. Hilbe M., Jaros P., Ehrensperger F. et al. Histomorphological and immunohistochemical findings in testes, bulbourethral glands and brain of immunologically castrated male piglets // Schweiz. Arch. Tierheilkd. 2006 V. 148, № 11. P. 599–608.
19. Hsu C.T., Ting C.Y., Ting C.J., Chen T.Y. et al. Vaccination against gonadotropin-releasing hormone (GnRH) using toxin receptor-binding domain-conjugated GnRH repeats // Cancer. Res. 2000. V. 60. P. 3701–3705.
20. Jeyakumar M., Moudgal N.R. Immunization of male rabbits with sheep luteal receptor to lutenizing hormone results in production of antibodies exhibiting hormone agonistic and antagonistic activities // J. Endocrinol. 1996. V. 150. P. 431–443.
21. Jeyakumar M., Suresh R., Krishnamurthy H.N. et al. Changes in testicular function following specific deprivation of luteinizing hormone in the adult male rabbit // J. Endocrinol. 1995. V. 147. P. 111–120.
22. Jones G.R., Sacco A.G., Subramanian M.G. et al. Histology of ovaries of female rabbits immunized with deglycosylated zona pellucida macromolecules of pigs // J. Reproduct. and Fertil. 1992. V. 95. P. 513–525.
23. Jones W.R., Judd S.J., Ing R.M.Y. et al. Phase I clinical trial of a world health organisation birth control vaccine // The Lancet. 1998. V. 331. Is. 8598. P. 1295–1298.
24. Kerr P.J., Jackson R.J., Robinson A.J. et al. Infertility in female rabbits (Oryctolagus cuniculus) alloimmunised with the rabbit zona pellucida protein ZPB either as a purified recombinant protein or expressed by recombinant myxoma virus // Biol. of Reproduct. 1999. V. 61. P. 606–613.
25. Landsteiner K. Zur Kenntris der spezifisch auf blutko rperchen wirkenden sera // Zb. Bakt. 1899. V. 25. P. 546–549.
26. Lemons A.R., Naz R.K. Contraceptive vaccines targeting factors involved in establishment of pregnancy // Am. J. Reprod. Immunol. 2011. V. 66. № 1. P. 13–25.
27. Liskin L., Pile J.M., Quillan W.F. Vasectomy safe and simple // Popul. Rep. 1983. V. 4. P. 61–100.
28. Luteinizing hormone. Электронный ресурс: http://en.wikipedia.org/wiki/Luteinizing_hormone.
29. Malthusianism. Электронный ресурс http://en.wikipedia.org/wiki/Malthusianism#Modern_Malthusianism.
30. Martinez M.L., Harris J.D. Effectiveness of zona pellucida protein ZPB as an immunocontraceptive antigen // J. Reprod. Fertil. 2000. V. 120. P. 19–32.
31. Meloen R.H., Wensing C.J. EP0464124 (A1). A peptide, immunogenic composition and vaccine or medicinal preparation / Stichting Centr. Diergeneeskund [Нидерланды]. Заявл. 23.03.1989; опубл. 08.01.1992.
32. Metchnikoff E. Etudes sur la resorption de cellule // Ann. Inst. Pasteur. 1899. V. 13. P. 737–779.
33. Miller L.A., Fagerstone K.A., Wagner D.C. et al. Factors contributing to the success of a single-shot, multiyear PZP immunocontraceptive vaccine for white-tailed deer // Human–Wildlife Conflicts. 2009. V. 3. № 1. P. 103–115.
34. Moudgal N.R., Ravindranath N., Aravindan G.R. et al. Anti-FSH antibody as a probe in determining the role of FSH in the maintenance of gonadal function in the primate // In Rosenwaks Z. и Spieler J.M. (Еds). Nonsteroidal Gonadal Factors: Physiological Roles and Possibilities in Contraceptive Development. 1988. CONDRAD Program. P. 249.
35. Moudgal N.R., Sairam M.R., Krishnamurthy H.N. et al. Immunization of male bonnet monkeys (M. radiata) with a recombinant FSH receptor preparation affects testicular function and fertility // Endocrinol. 1997a. V. 138. P. 3065–3068.
36. Moudgal N.R., Sheela Rani C.S. Advances in immunology of gonadotropins // In Li C.H. (Еd.). Hormonal Proteins and Peptides. 1983. Academic Press, New York. P. 135.
37. Moudgal1 N.R., Jeyakumar M., Krishnamurthy H.N. et al. Development of male contraceptive vaccine — a perspective // Human Reproduction Update. 1997. V. 3. № 4. P. 335–346.
38. Murthy G.S. R.C., Srilatha N.S. Mapping of assembled epitope with microgram qualities of antigen: identification of an epitope at the receptor binding region of human follicle stimulating hormone // Curr. Sci. 1996. V. 70. P. 1019–1022.
39. Murty G.S.R.C., Sheela Rani C.S., Moudgal N.R. et al. Effect of passive immunization with specific antiserum to FSH on the spermatogenic process and fertility of adult male bonnet monkeys (Macaca radiata) // J. Reprod. Fertil. 1979. V. 26 (Suppl.). P. 147–163.
40. Naz R.K. Antisperm contraceptive vaccines: where we are and where we are going? // Am. J. Reprod. Immunol. 2011а. V. 66. P. 5–12.
41. Naz R.K. Contraceptive vaccines: success, status, and future perspective // Am. J. Reprod. Immunol. 2011б. V. 66. P. 2–4.
42. Naz R.K. Development of genetically engineered human sperm immunocontraceptives // J. Reprod. Immunol. 2009. V. 83. № 1–2. P. 145–150.
43. Naz R.K. Immunocontraceptive effect of Izumo and enhancement by combination vaccination // Mol. Reprod. Dev. 2008. V. 75. P. 336–344.
44. Naz R.K. Status of contraceptive vaccines // Am. J. Reprod. Immunol. 2009. V. 61. № 1. P. 1–18.
45. Naz R.K., Chauhan S.C. Human sperm-specific peptide vaccine that causes long-term reversible contraception // Biol. Reproduce. 2002. V. 67. P. 674–680.
46. Naz R.K., Guptan S.K., Gupta J.C. et al. Recent advances in contraceptive vaccine development: a mini-review // Hum. Reprod. 2005. V. 20. № 12. Р. 3271–3283.
47. Nazari M., Mirshahi M., Mowla S.J. et al. Investigation in vitro expression of CatSper sub fragment followed by production of polyclonal antibody: potential candidate for the next generation of non hormonal contraceptive // Cell. J. 2012. V. 14, № 3. P. 215–24.
48. Nieschlag E. Reasons for abandoning immunization against FSH as an approach to male fertility regulation // In Zatuchni G.I., Goldsmith A., Spieler J.M. и Sciana J.J. (Еds). Male contraception: Advances and Future prospects. Professional Series on Fertility Regulation, Harper and Row, Philadelphia. 1985. P. 395.
49. Ohl D., Naz R.K. Infertility due to antisperm antibodies // J. Urol. 1995. V. 46. P. 591–602.
50. Pau K.Y., Spie H.G. Neuroendocrine signals in the regulation of gonadotropin-releasing hormone secretion // Chin. J. Physiol. 1997. V. 31. № 40. P. 181–196.
51. Potter A.A., Manns J.G. NZ333999 (A). GnRH-leukotoxin chimeric proteins for use in vaccines / Univ. Saskatchewan [Канада]. Заявл. 08.09.1996; опубл. 28.07.2000.
52. Rockefeller Foundation. Электронный ресурс http://en.wikipedia.org/wiki/Rockefeller_Foundation.
53. Roy B.M. WO 88/01176. Regulating animal reproduction // Bunge Australia [Австралия]. Заявл.18.08.1986; опубл. 25.02.1988.
54. Sacco A.G., Pierce D.L., Subramanian M.G. et al. Ovaries remain functional in squirrel monkeys (Saimiri sciureus) immunized with porcine zona pellucida 55 000 macromolecule // Biol. Reproduct. 1987. V. 36. P. 481–490.
55. Saenziturriaga L. US2012093846 (A1). Protein for the immunocastration for mammals // Saenziturriaga L. [Чили]. Заявл. 15.04.2009; опубл. 19.04.2012.
56. Saxena B.B., Rathnam P. US2005/0032171. hCG-hLH receptor and hCG-hLH receptor-hCG complex as antigens, antibodies thereto and contraceptive vaccine // Cornell. Res. Foundation Inc. [США]. Заявл. 11.03.1993; опубл. 10.02.2005.
57. Schanbacher B.D. Effects of active immunization of the ram and bull against luteinizing hormone // Thenogenology. 1985. V. 24. № 1. P. 59–71.
58. Sheela Rani C.S., Murty G.S.R.C., Moudgal N.R. Effect of chronic neutralization of endogenous FSH on testicular function in the adult male bonnet monkey – assessment using biochemical parameters // Int. J. Androl. 1978. V. 1. P. 489–500.
59. Shirubaasa D.D., Maafui B.D., Meipurutofuto R.J. et al. JPH02113 (A). Agent and method for stimulating immune response to GNRH to immunologically make mammal sterile / Univ. Saskatchewan [Канада]. Заявл. 30.09.1987; опубл. 01.05.1990.
60. Skrlep M., Segula B., Zajec M. et al. Effect of immunocastration (Improvac ®) in fattening pigs I: gro wth performance, reproductive organs and malodorous com pounds // Slov. Vet. Res. 2010. V. 47. № 2. P. 57–64.
61. Spieler J. Development of immunological methods of fertility regulation // Bulletin of the World Health Organization. 1987. V. 65. № 6. P. 779–783.
62. Srinath B.R., Wickings E.J., Witting C., Nieschlag E. Active immunization with follicle stimulating hormone for fertility control: a 4,5 year study in male rhesus monkeys // Fertil. Steril. 1983. V. 40. P. 110–117.
63. Srivastava N., Santhanam R., Sheela P. et al. Evaluation of the immunocontraceptive potential of Escherichia coli-expressed recombinant dog ZP2 and ZP3 in a homologous animal model // Reproduction. 2002. V. 123. P. 847–857.
64. Stevens V.C. Immunological approaches to fertility regulation // Bull. WHO. 1978. V. 56, № 2. P. 179–192.
65. Stevens V.C., Cinader B., Powell J.E. et al. Preparation and formulation of a human chorionic gonadotropin antifertility vaccine: selection of adjuvant and vehicle // Am. J. Reprod. Immunol. 1981a. V. 1. P. 315–321.
66. Stevens V.C., Cinader B., Powell J.E. et al. Preparation and formulation of a human chorionic gonadotropin antifertility vaccine: selection of peptide immunogen // Am. J. Reprod. Immunol. 1981b. V. 6. P. 307–314.
67. Suresh R., Medhamurthy R., Moudgal N.R. Comparative studies on the effects of specific immunoneutralization of endogenous FSH or LH on testicular germ cell transformations in the adult bonnet monkey (Macaca radiata) // Am. J. Reprod. Immunol. 1995. V. 34. P. 35–43.
68. Suresh R., Moudgal N.R. A role of nocturnal serum testosterone surge in regulating spermatogenesis in the adult non-human primate // Endocrine. 1995. V. 3. P. 487–492.
69. Talwar G.P. Contraception–immunological // Delves P.J., Roitt I. (eds), Encyclopaedia of Immunology. 2nd edn. Academic Press, London, 1997.
70. Talwar G.P. Vaccines for control of fertility and hormone-dependent cancers // Immunol. Cell Biol. 1997. V. 75. P. 184–9.
71. Talwar G.P., Chaudhuri M. K., Jayashankar R. GB2228262. Antigenic derivative of GnRH // Nat. Inst. Immunology [Индия]. Заявл.05.04.1989; опубл. 22.08.1990.
72. Talwar G.P., Sharma N.C., Dubey S.K et al. Isoimmunization against human chorionic gonadotropin with conjugates of processed β-subunit of the hormone and tetanus toxoid // Proc. Natl. Acad. Sci. USA. 1976a. V. 73. P. 218–222.
73. Talwar G.P., Singh O., Rao L.V. An improved immunogen for anti-human chorionic gonadotropin vaccine eliciting antibodies reactive with a conformation native to the hormone without crossreaction with human follicle stimulating hormone and human thyroid stimulating hormone // J. Reprod. Immunol. 1988. V. 14. P. 203–212.
74. Tollner T.L., Overstreet J.W., Branciforte D. et al. Immunization of female Cynomolgus macaques with a synthetic epitope of sperm-specific lactate dehydrogenase results in high antibody titres but does not reduce fertility // Mol. Reprod. Dev. 2002. V. 62. P. 257–264.
75. Upadhyay S. N., Thillaikoothan P., Bamezai A. et al. Role of adjuvants in inhibitory influence of immunization with porcine zona pellucida antigen (ZP-3) on ovarian folliculogenesis in bonnet monkeys: a morphological Study // Biology of Reproduction. 1989. V. 41. P. 665–673.
76. Urbanski H. Differential roles of GnRH-I and GnRH-II neurons in the control of the primate reproductive axis // Front. Endocrin. 2012. V. 3. Article 20 (doi: 10.3389/fendo.2012.00020).
77. Wassarman P.M. Zona pellucida glycoproteins // The Jour. Biol. Hem. 2008. V. 283. № 36. P. 24285–24289.
78. Yousafzai S. Pakistan: Mullahs and Militants Keep Polio Alive: электронный ресурс http://www.thedailybeast.com/articles/2012/12/19/pakistan-mullahs-and-militants-keep-polio-alive.html#url=/articles/2012/12/19/pakistan-mullahs-and-militants-keep-polio-alive.html.
79. Zona pellucida. Электронный ресурс http://ru.wikipedia.org/wiki/Zona_pellucida.
Библиографическое описание: Супотницкий М.В. Контрацептивные вакцины // Актуальная инфектология. — 2014. – № 1. — С. 67–89.
Bibliographical description: Supotnitskiy М.V Contraceptive vaccines // Actual Infectology. — 2014. – № 1. — P. 67–89.
Библиографическое описание: Супотницький М.В. Контрацептивнi вакцини // Актуальна iнфектологiя. — 2014. – № 1. — С. 67–89.
Материал планировался для включения в мою монографию «Биологическая война» в качестве раз. 2.3.6. Но из-за обилия материалов, я не успел его подготовить в срок, определенный издательством
[1] Желтое тело (corpus luteum) — временная железа внутренней секреции в женском организме, образующаяся после овуляции и вырабатывающая гормон прогестерон. Название жёлтое тело получило благодаря жёлтому цвету своего содержимого.
[2] Адъюванты Фрейнда: неполный адъювант представляет собой водно-жировую эмульсию, содержащую вазелиновое масло, ланолин и эмульгатор. Депонирует антиген и усиливает его захват фагоцитами. Полный адъювант включает в себя, кроме вышеперечисленных компонентов, БЦЖ или мурамилдипептид. Это позволяет ему дополнительно активировать макрофаги и костимулировать Т-клетки.
[3] Клетки Лейдига — гормонопродуцирующие клетки млекопитающих, расположенные между семенными канальцами в семенниках, в них производится тестостерон и другие соединения андрогенного ряда, также в них образуется небольшое количество женских половых гормонов эстрогенов и прогестинов. Клетки Лейдига стимулируются LH.
[4] Акросома (апикальное тельце, перфораторий) — органоид сперматозоида, расположенный в передней части его головки. Представляет собой мембранный пузырек, содержащий ферменты, растворяющие яйцевую оболочку яйцеклетки — zona pellucida. При оплодотворении в результате воздействия на сперматозоид сигнальных веществ оболочки яйцеклетки и содержимого яйцевода происходит акросомная реакция, в ходе которой акросома сливается с наружной мембраной яйцеклетки и растворяет ее.
[5] Азооспермия — патологическое состояние, при котором в эякуляте отсутствуют сперматозоиды.
[6] Сперматида — мужские половые клетки на 4-й стадии развития. Обладают гаплоидным набором хромосом. Возникают в результате деления сперматоцитов второго порядка. В результате цикла структурных изменений превращаются в сперматозоиды.
[7] Сперматоцит — мужской гаметоцит. В процессе сперматогенеза появляется из сперматогоний путём мейотического деления. Процесс происходит в семенных канальцах тестикул.
[8] Сперматогонии — диплоидные исходные мужские половые клетки.
[9] Олигозооспермия — снижение количества сперматозоидов в эякуляте меньше, чем 20 млн/мл.
[10] Эмбрион — стадия развития организма, начиная со стадии зиготы до рождения или выхода из яйцевых оболочек.
[11] Гиалин — полупрозрачное стекловидное белковое вещество плотной консистенции, стойкое к действию кислот и щелочей, окрашивающееся кислыми красками.
[12] Вазэктомия — хирургическая операция, при которой производится перевязка или удаление фрагмента семявыносящих протоков у мужчин. Эта операция приводит к стерильности при сохранении половых функций. У мужчины после вазэктомии сохраняется половое поведение: либидо, эрекция, эякуляция. Но непроходимость семявыносящих протоков приводит к отсутствию в эякуляте сперматозоидов.
[13] Придаток яичка (эпидидимис) — парный орган мужской половой системы, служащий для созревания, накопления и продвижения сперматозоидов.
[14] Капацитация — комплекс физиологических преобразований, в результате которых сперматозоид приобретает способность проникать в яйцеклетку; предполагается, что в процессе капацитации происходит удаление с поверхности сперматозоидов факторов, блокирующих активность акросом.
[15] Зигота — клетка, образующаяся в результате слияния яйцеклетки и сперматозоида.
[16] Бластоциста — ранняя стадия развития зародыша млекопитающих (в том числе человека). Стадия бластоцисты следует за стадией морулы и предшествует стадии зародышевого диска. Стадия бластоцисты относится к преимплантационному периоду развития, то есть самому раннему периоду эмбриогенеза млекопитающих (до прикрепления зародыша к стенке матки).
[17] В первую фазу клинических исследований вакцин входит изучение их реактогенности, безопасности и специфической активности на ограниченных контингентах людей.
[18] Во вторую фазу клинических исследований вакцин входит изучение их безопасности, иммунологической и антифертильной эффективности на расширенных контингентах людей.
[19] Федеральный закон Российской Федерации от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств» // Российская газета. — 2010. — № 5157. — 14 апреля.

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.
Метки: 2014, вакцины, контрацептивные вакцины

