Микроорганизмы, токсины и эпидемии. 2.3. Чувствительность к возбудителям инфекционных болезней у отдельных этнических групп и человеческих популяций
Восприимчивая популяция является третьим звеном классической эпидемической цепи. Для того чтобы возникла и распространилась новая инфекционная болезнь, недостаточно наличия природного резервуара возбудителя и возможностей для его передачи. Эпидемический процесс будет развиваться в том случае, если в популяции имеются восприимчивые к возбудителю инфекционной болезни люди.
Генетическая природа восприимчивости к возбудителям инфекционных болезней еще только начинает изучаться. Устойчивость и восприимчивость относятся к пороговым признакам. Чаще всего они носят полигенный характер. Такой генетический контроль не дает возможность разграничить фенотипы вследствие маскирующего действия условий среды и небольшого эффекта отдельных генов. Частоты отдельных генов в инфицированной популяции варьируют. Поэтому наблюдается множество переходных вариантов патологии между типичными формами проявления инфекционной болезни (рис. 46).
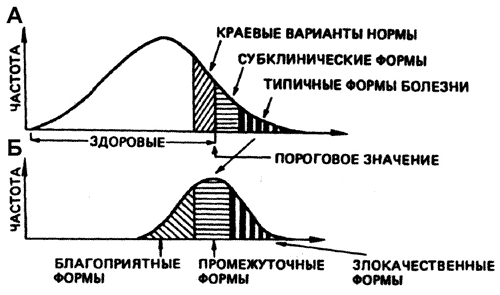
Рис. 46. Клинические признаки инфекционной болезни при полигенной устойчивости и восприимчивости к микроорганизму.
А. Разнообразие стертых и субклинических вариантов, которые образуют непрерывный переход от нормы до выраженных форм типичного проявления инфекционной болезни;
Б. Множество переходных вариантов патологии между типичными формами проявления инфекционной болезни (по В.Л. Петухову и соавт., 1996).
Люди, наследственно восприимчивые к возбудителю инфекционной болезни, не заболевают, если не было их экспонирования этим возбудителем. Поэтому вне эпидемического процесса такие признаки могут рассматриваться как нейтральные. Однако при контакте с возбудителем инфекционной болезни, они становятся селективными и их носители подпадают под действие естественного отбора.
В качестве примера такого отбора приведем систему групп крови у человека. Раньше принималось, что группы АВО нейтральны. Однако, как оказалось, это не так. Среди коренного населения Пиренеев практически нет носителей гена В. По мере продвижения к древним очагам оспы и чумы они встречаются все чаще. В районе Астрахани их уже около 35%. По направлению к Индии, Китаю и Индокитаю процент носителей гена В еще выше. Оказывается люди с группой крови В, труднее инфицируются возбудителями чумы и натуральной оспы, и легче переносят вызываемые ими болезни (рис. 47).
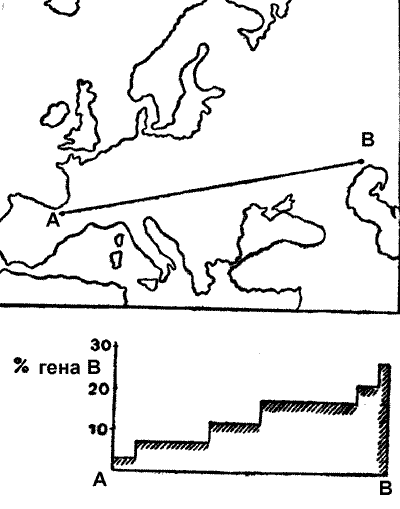
Рис. 47. Распространение групп крови В в Европе. По мере продвижения к азиатским очагам оспы и чумы процент носителей гена В возрастает [Медников Б.М., 1975]. Это своего рода генетический шрам великих моров прошлого.
На примере генетической устойчивости людей к туберкулезу Lurie и Dannenberg выделяют следующие ее виды для микроорганизмов:
1) устойчивость к возникновению инфекции, т. е. устойчивость в первоначальной стадии размножения микроорганизма в хозяине (например, способность альвеолярных макрофагов эффективно фагоцитировать микобактерии);
2) устойчивость к дальнейшему развитию болезни, т. е. удержание инфекции в состоянии латентности (например, торможение размножения микобактерий в хилусных лимфатических узлах) [цит. по В.Л. Петухову с соавт., 1996].
Виды генетической устойчивости к простейшим приведены ниже (см «малярия»). Сейчас рассмотрим связь главного комплекса гистосовместимости (МНС от «major histocompatibility complex») с генетической устойчивостью (предрасположенностью) к возбудителям инфекционных болезней, а также механизмы генетической устойчивости (предрасположенности), которые не реализуются непосредственно через иммунную систему.
Главный комплекс гистосовместимости. У человека МНС имеет второе название — система HLA (от англ. Human leucocyte antigens) в связи с тем, что контролируемые ею трансплантационные антигены хорошо представлены на лейкоцитах. Гены главного комплекса гистосовместимости расположены у человека на 6-й хромосоме в диске р21.3 и занимают значительный участок ДНК, включающий до 4*106 пар оснований (50 генов). Основными особенностями комплекса являются: 1) его значительная полигенность — наличие нескольких неаллельных генов; 2) ярко выраженный полиморфизм — присутствие многих аллельных форм одного и того же гена. Все гены комплекса наследуются по кодоминантному типу. Ни одна другая генетическая система организма не имеет такого количества аллельных форм определенного гена, как МНС. У человека наибольшее число аллельных вариантов (от 20 до 70) известно для генов I класса и Dpбета, Dqбета и Drбета генов II класса. У разных этнических групп число аллелей различается. Из-за большого количества аллелей изоантигенов МНС, вероятность подбора двух людей с одинаковыми трансплантационными антигенами крайне незначительна. Кодоминантное наследование, сочетающее полигенность и полимофизм МНС, определяет индивидуальную чувствительность особей данного вида к возбудителям инфекционных болезней [Галактионов В.Г., 1998] (рис. 48).
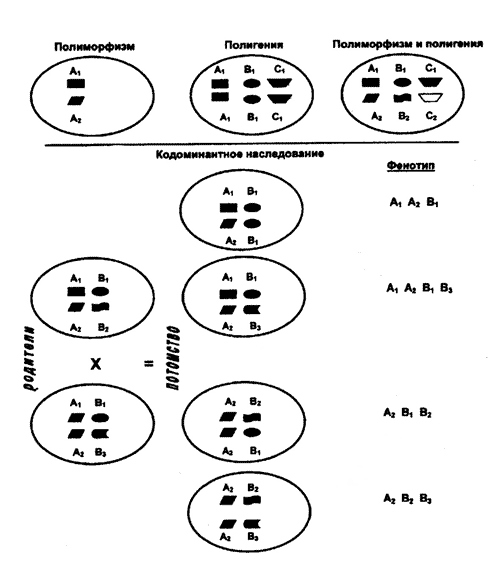
Рис. 48. Схема кодоминантного наследования генов МНС. Полиморфизм генов МНС определяет наличие многих аллельных вариантов одного и того же гена (А1 , А2 и т.д.). Под полигенией понимают наличие нескольких неаллельных, близкосцепленных генов, контролирующих изогенные признаки (А1, В1, С1 или А2, В2, С2) [Галактионов В.Г., 1998].
Кодируемые генами комплекса белки взаимодействуют с антиген-специфическими клеточными поверхностными рецепторами Т-лимфоцитов, вызывая активацию лимфоцитов и иммунную реакцию.
Молекулы I класса экспрессируются на поверхности всех ядросо-держащих клеток организма и представляют собой гетеродимеры, включающие тяжелую альфа-цепь и однодоменный бета2-микроглобулин, нековалентно связанный с основным полипептидом. Связывание антигенного пептида молекулой I класса происходит в антигенсвязывающей щели, образованной альфа-спиральными участками альфа- и альфа2-доменов. Антигены I класса определяют индивидуальную антигенную специфичность, они представляют любые чужеродные антигены Т-цитотоксическим (CD8+) лимфоцитам. При вирусной инфекции они вызывают гибель инфицированных вирусом клеток-мишеней [Галактионов В.Г., 1998].
Молекулы II класса представляют собой гетеродимеры, состоящие из двух нековалентносвязанных цепей: альфа и Р, каждая из которых включает два домена (альфа1 альфа2 и бета1бета2, соответственно). Назначение МНС класса II заключается в том, что они обеспечивают взаимодействие между макрофагами и В-лимфоцитами. Антигены класса II участвуют в формировании всех видов иммунного ответа: противомикробного, трансплантационного, противоопухолевого и др.
Связь между свойствами МНС и классами генов представлена в табл. 25.
Таблица 25
Связь между свойствами МНС и классами генов
|
Свойства |
Гены класса I |
Гены класса II |
|
Интенсивное отторжение трансплантанта |
++++ |
+ |
|
Образование антител |
++++ |
++++ |
|
Стимуляция бласттрансформации |
+ |
++++ |
|
Реакция «трансплантант против хозяина» |
+ |
++++ |
|
Клеточная реакция аллогенного лимфолиза* |
++++ |
|
|
Контроль силы иммунного ответа |
+ |
++++ |
|
Уровень рестрикции** |
Лизис клеток-мишеней |
Антигенпредставляющая клетка |
|
Распределение антигенов по тканям |
Повсеместно |
Преимущественно макрофаги и В-лимфоциты |
Примечания: *рестрикция — способность продуктов генов МНС ограничивать функции Т-лимфоцитов в индукции, межклеточной кооперации и эффекторных механизмах иммунного ответа. Элементами рестрикции Т-цитотоксических лимфоцитов являются белки МНС класса I, Т-хелперов — белки МНС класса II;
**аллогенный лимфолиз — способность сенсибилизированных лимфоцитов разрушать клетки-мишени, идентичные тем клеткам, которые вызвали сенсибилизацию [Коротяев А.И., Бабичев С.А., 1998].
Причины, способствующие ассоциации между отдельными факторами МНС и возбудителями инфекций, еще только выясняются. Однако их наличие уже не вызывает сомнение.
Например, с полиморфизмом антигенов МНС связано такое явление, как генетический контроль иммунного ответа (см. табл. 25). В тех случаях, когда аминокислотные остатки, образующие щель у антигенов II класса, не в состоянии связать пептидный фрагмент чужого антигена, Т-хелперы остаются ареактивными и их помощь В-клеткам не реализуется. Это обстоятельство и является причиной генетически детерминированного дефекта в иммунном реагировании на возбудитель инфекционной болезни [Галактионов В.Г., 1998].
Так как люди с таким генетическим дефектом не реагируют на некоторые критические эпитопы патогенов, то инфекционная болезнь у них развивается значительно легче, чем у тех лиц, у которых Т-хелперы активируются. По сходному механизму развивается инфекционная болезнь у людей с неадекватной аллелью антигена I типа. Поэтому при анализе распределения аллелей МНС, люди с аллелью, неспособной к связыванию данного антигена, обнаруживаются среди больных в статистически значимых ассоциациях.
Другая известная причина ассоциации МНС с отдельными инфекционными болезнями заключается в том, что антигенные структуры возбудителя имитируют или моделируют молекулы МНС. Это приводит к развитию аутоиммунитета против молекул МНС и к дисфункции и истощению Т-клеток. В результате иммунная система утрачивает способность противодействовать возбудителю, развивается болезнь. Учитывая то, что комплекс МНС играет универсальную роль во всевозможных реакциях распознавания и взаимодействия на клеточном уровне, то можно предположить существование намного большего количества генетически опосредованных механизмов влияния комплекса на сопротивляемость организма к инфекционным болезням.
В табл. 26 перечислены ассоциации, установленные между различными факторами МНС и некоторыми инфекционными болезнями. Указаны лишь антигены, обнаруживаемые в статистически значимой ассоциации. Некоторые возбудители инфекционных болезней ассоциируют с одними и теми же факторами МНС, что частично объясняет ассоциации этих возбудителей в эпидемических процессах, протекающих в отдельных этнических группах (например, ВИЧ, возбудители гепатита В, проказы и туберкулеза среди представителей негроидной расы).
Таблица 26
Связь между человеческим лейкоцитарным антигеном и некоторыми инфекционными болезнями*
|
Болезнь |
Связь с HLA |
|
Бактериальные |
|
|
- Анкилозирующий спондилоартрит |
В27 |
|
- Болезнь Рейтера |
В27 |
|
- Острый передний увеит |
В7 |
|
Микобактериальные |
|
|
Туберкулез и лепра |
DR2 |
|
(мультибациллярные формы) |
(DRB1*1501, 1502) |
|
Лепроматозная лепра |
DR2 и DQ1 |
|
с небольшим количеством бацилл, напоминающая туберкулез |
DR3 |
|
Вирусные |
|
|
Лихорадка Денге |
DR15 |
|
СПИД (ВИЧ 1) |
DR13, DRB1*1301, 1302, 1303), DR2, (DRB1*1501), DRB1*03011 |
|
Гепатит В |
DR13 |
|
Гепатит С |
А2, DR5 |
|
Вирус Эпштейна—Барра |
В35.01 А11 В7 |
|
Паразитарные |
|
|
Малярия |
В53 |
|
Чесотка |
А11 |
|
Диффузный кожный лейшманиоз |
А11, В5, В7 |
|
Локализованный кожный лейшманиоз |
A28, BW22, DQw8, BW22, DR11, Qw7, Bw22, Dqw3 |
|
Шистосомоз |
B5, DR3 |
|
Висцеральный лейшманиоз |
А26 |
* По N. Singh и соавт., 1997.
Вирус иммунодефицита человека. С конца 1970-х гг. от СПИДа умерло более 8 млн. человек и конца этой эпидемии не видно. Пока оказываются бессильными все попытки создать надежные средства лечения и профилактики вызываемой ВИЧ болезни. Бессильны и противоэпидемические мероприятия. В связи с этим неизбежно возникает вопрос, а может ли вообще вид Homo sapiens сохраниться после завершения этой пандемии? Можно сформулировать вопрос мягче — есть ли у человека генетическая устойчивость к ВИЧ?
Роль хемокиновых рецепторов в устойчивости к ВИЧ. Совсем недавно, в 1997 г., исследователи обнаружили протективное действие гомозиготности по делеции в 32 bp (bp — пара оснований) в гене хемокинового рецептора CCR5 [Zimmerman P. et al., 1997]. Было описано более 60 человек из групп повышенного риска, гомозиготных по делеции в CCR5, которые оставались неинфицированными при многократном экспонировании к ВИЧ. У гетерозиготных по делеции CCR5 лиц, развитие клинических симптомов болезни наступало значительно позже, чем у лиц гомозиготных по «дикому» типу гена. Чтобы понять механизм этого явления, посмотрим, что из себя этот рецептор представляет.
Хемокиновые рецепторы — поверхностные белки, связывающие небольшие белковые молекулы, называемые хемокинами. Хемокины по количеству и расположению консервативных цистеиновых остатков могут быть классифицированы на три группы — С, СС и СХС. На основе способности связывать различные хемокины, хемокиновые рецепторы делятся на связывающие СС, СХС или оба типа лимфокинов одновременно (табл. 27).
Таблица 27
Связь рецепторов хемокинов человека с инфекционными болезнями
|
Рецепторы (старое наименование)
|
Лиганды |
Предоминантная экспрессия/распределение по тканям |
Патогены, использующие данный рецептор для инфицирования |
Локализация на хромосоме |
|
|
СС хемокины |
СХС хемокины |
||||
|
СС-рецепторы CCR1 (СС CKR1) |
МIР-1а, b RANTES МСР-3 |
|
Моноциты, Т-клетки |
|
Зр21 |
|
CCR2A (МСР-1Ra) |
МСР-1 |
|
Т-клетки, базофилы, моноциты |
|
Зр21 |
|
CCR2B (MCP-1Ra) |
МСР-1, 2, 3 |
|
|
ВИЧ-1 (NSI) |
|
|
CCR3 (CKR3) |
Эотаксин, RANTES, МСР-2, 3, 4 |
|
Базофилы, эозинофилы, микроглиальные клетки, и, возможно, моноциты; небольшая экспрессия в дендрических клетках или Т-лимфоцитах периферической крови |
ВИЧ-1 (NSI) |
Зр21 |
|
CCR4 |
TARC |
|
Базофилы, Т-клетки |
|
Зр24 |
|
CCR5 (СС CKR5) |
MlP-la, P RANTES |
|
Моноциты, дендрические клетки, макроглиальные клетки, Т-клетки |
ВИЧ-1 (NSI), ВИЧ-2 |
Зр21 |
|
СХС рецепторы CXCR1 (IL-8 RA) |
|
IL-8 |
Нейтрофилы, НК-клетки |
|
2q35 |
|
CXCR2 (IL-8 RA) |
IL-8, MGSA, gro-альфа, NAP-2, IP-10, ENA-78, Mig |
|
|
|
|
|
CXCR3 |
|
IP-10, Mig |
Активированные Т-клетки |
|
|
|
CXCR4 (фузин, LESTR, HUMSTR) |
|
SDF-1 |
Очень распространен: CD4+- и CD4– -клетки, моноциты, макрофаги, дендрические клетки, В-клетки; другие ткани, например, мозг, легкие, селезенка |
ВИЧ-1 (SI), ВИЧ-2 |
2q21 |
|
СС/СХС рецептор DARC (Duffy-антиген) |
RANTES, MCP-1, TARC и т.д. |
IL-8, MGSA, gro-альфа и т.д. |
Эндотелиальные клетки, эритроциты |
Plasmodium vivax |
1 |
|
Другие STRL33 |
Неопределены |
Неопределенны |
Лимфоидная ткань и активированные Т-клетки |
|
|
|
HCMV-US28 |
MlP-l альфа, бета, RANTES |
|
Фибробласты, инфицированные CMV |
ВИЧ-1 |
Нет |
|
ChemRl |
Неопределeны |
Неопределенны |
Т-лимфоциты, полиморфно-ядерные клетки |
|
Зр21-24 |
|
CMKBRL1 |
Неопределены |
Неоп- ределен ны |
Нейтрофилы, моноциты, мозг, печень, легкие, скелетные мышцы |
|
Зр21 |
|
TER1 |
То же |
То же |
Тимус, селезенка |
|
Зр21 |
|
V28 |
То же |
То же |
Нервная и лимфоидная ткани |
|
Зр21 |
|
D2S201E |
То же |
То же |
Распространен широко, включая клетки гемопоэтического происхождения |
|
Зр21 |
|
BLR1 |
То же |
То же |
В-лимфоциты |
|
|
|
ЕВН |
То же |
То же |
То же |
|
|
|
GPR 1,2,5 |
|
|
|
Неопределены |
|
Сокращения: BLR1 рецептор 1 лимфомы Буркитта; CMKBRL1 — хемокин подобный бета-рецептор 1; DARC — duffy-антиген/рецептор для хемокинов; ЕВН — рецептор, индуцируемый вирусом Эпштейна—Барра; ENA78 — полученный из эпителия нейтрофилактивирующий пептид-78; GPR — G-хемокин, присоединяющий рецептор; gro — связанный с ростом продукт гена; HCMV — цитомегаловирус человека; HUMSTR — рецептор человеческого сывороточного трансмембранного сегмента; IL — интерлейкин; IP-10 — интерферон-гамма индуцибельный 10 кд белок; LESTR — сегмент лейкоцитэспрессируемого трансмембранного рецептора; МСР — белок хемотаксиса лимфоцитов; Mig — монокины, индуцируемые гамма-интерфероном; MIP — макрофаговый воспалительный белок; NSI — не индуцирующие синтиций вирусы; NAP2 — нейтрофилактивирующий белок 2; RANTES — регулируемые при активации, нормальные Т-клеточные экспрессированные и секретированные хемокины; SDF-1 — фактор 1, производный из клеточной стромы; STRL33 — рецептор, включающий 7 трансмембранных доменов, полученный из 33-го лимфоцитарного клона; TARC — хемокины, регулируемые тимусом и активацией [McNicholl J. еt al., 1997]
Первыми ключ к разгадке роли хемокиновых рецепторов в развитии ВИЧ-инфекции подобрали исследователи знаменитой лаборатории д-ра Галло, обнаружившие, что высокий уровень хемокинов ингибирует репликацию ВИЧ в условиях in vitro [Cocchi F. et al, 1995]. Вскоре публикации работ о роли хемокиновых рецепторов в развитии ВИЧ-инфекции и, в частности, рецепторов CXCR4 и CCR5, приобрели взрывной характер. Установлена связь этих рецепторов с возбудителями инфекционных болезней (рис. 49).
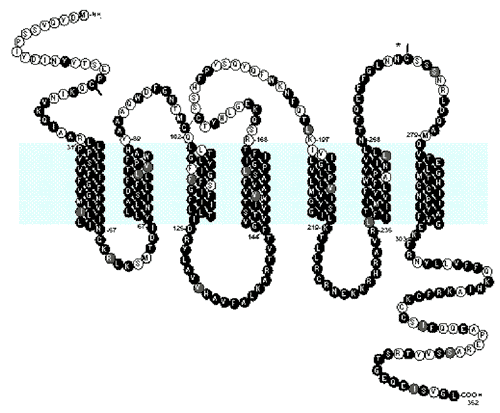
Рис. 49. Предполагаемая структура и аминокислотная последовательность CCR5. Обычно этот рецептор представлен тремя внутриклеточными, тремя внеклеточными и семью трансмембранными доменами. Горизонтальная окрашенная полоса соответствует клеточной мембране. Аминокислотные остатки, соответствующие CCR1b, окрашены в черный цвет. Светлого цвета консервативные структуры [McNicholl J. еt al., 1997].
Точный механизм, благодаря которому ВИЧ проникает в клетку посредством CXCR4 и CCR5, и роль рецептора CD4 в этом механизме, неизвестны. Предполагается, что пенетрация вируса осуществляется посредством взаимодействия VЗ-петли и других участков его наружного оболочечного белка gp120 и внеклеточных доменов CCR5- и ССR2b-рецепторов, и может включать многоэтапное взаимодействие с CD4 и другими клеточными поверхностными компонентами. Хемокины могут блокировать проникновение вируса посредством блокирования рецептора, снижения его афинности или ингибирования последующих этапов процесса пенетрации [Oravecz Т. et al., 1996].
Делеция в 32 bp образуется в участке повторяющегося мотива гена CCR5. В результате сдвигается рамка считывания в кодирующей рецепторный белок нуклеотидной последовательности, и синтезируемая дефектная форма рецептора утрачивает три из 7 трансмембранных доменов, 2 из 3 наружных петель и внутриклеточный сигнальный домен [McNicholl J. et al., 1997] (рис. 50, 51 и 52).

Рис. 50. Предполагаемая структура и аминокислотная последовательность мутантной формы рецептора CCR5. Мутантный белок утрачивает, по крайней мере, три трансмембранных сегмента CCR5 из 7 трансмембранных доменов, 2 из 3 наружных петель и внутриклеточный сигнальный домен — в результате ВИЧ не может «узнать» клетку-мишень [McNicholl J. еt al., 1997].
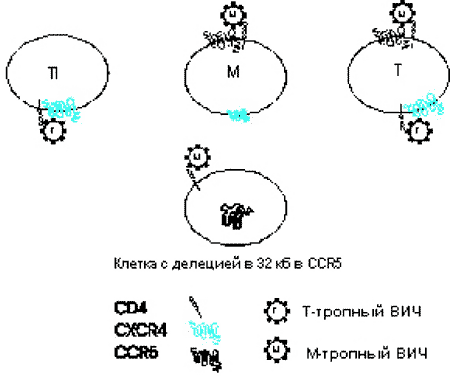
Рис. 51. Хемокиновые рецепторы и клеточный тропизм к ВИЧ. На схеме показаны три типа клеток — пассированные Т-клеточные линии (Т1), моноцит/макрофаг (М) и циркулирующие Т-клетки (Т). Т-клеточные линии экспрессируют CXCR4, но не CCR5; макрофаги и циркулирующие в периферической крови Т-клетки экспрессируют оба рецептора, хотя количество CXCR4 у них меньше чем на макрофагах. М-тропность у ВИЧ вызвана способностью белковых структур его оболочки связываться с CCR5 и проникать в оба типа макрофагов, а также в циркулирующие в крови Т-клетки. Т-тропный ВИЧ преимущественно связывается с CXCR4 и проникает в Т-клетки или Т-клеточные линии. После связывания с рецепторами хемокинов и рецептором CD4, вирус сплавляется с клеточной мембраной. Клетки с 32 bр делецией в гене CCR5 не экспрессируют кодируемый им белок и, хотя М-тропный ВИЧ может связываться с CD4, он не может проникнуть в клетку. Если клетки экспрессируют CXCR4, они могут быть инфицированы Т-тропным вирусом [McNicholl J. еt al., 1997].

Рис. 52. Участок CCR5 гена и аминокислотная последовательность с делецией в 32 bр. Повышенную частоту встречаемости 32 bр делеций гена CCR5 в человеческой популяции, можно рассматривать как своеобразный генетический шрам, оставленный прошлыми эпидемиями СПИДа. Интересно, что африканцы, которые непосредственно контактируют с природным резервуаром возбудителя СПИДа среди африканских приматов, оказывается, менее знакомы с ним, чем европейцы. Рисунок J. McNicholl и соавт., 1997.
Является ли резистентность к ВИЧ у людей, гомозиготных по мутации в рецепторе CCR5, абсолютной? К сожалению, нет.
Другие рецепторы, например, CCR3 и CCR2b также являются кофакторами проникновения в клетки отдельных серотипов ВИЧ. Т. е. Люди с генотипом CCR5 ▲32/▲32 лишь относительно резистентны к ВИЧ. Однако эта относительная устойчивость может быть довольно значительной. По крайней мере, описан один пациент, у которого болезнь не развилась даже после переливания инфицированной крови [O'Brien Т. et al., 1997]. У лиц с одной копией мутантного гена развитие болезни затягивается на два года по сравнению с лицами, гомозиготными по гену дикого типа [McNicholl J. et al., 1997].
Распределение в популяциях риска мутации гена рецептора CCR5, имеет четко выраженный этнический и расовый характер. По данным различных авторов у кавказцев гомозиготные лица в популяции могут составлять 1% при 10–20% гетерозиготных [McNicholl J. et al., 1997]. Этот ген встречается у 20% людей белой расы [Garred P., 1998]. У афроамериканцев в популяции до 6% гетерозигот, у испанцев до 7%, у азиатов менее 1%. Среди африканцев, таиландцев, японцев и корейцев практически не встречаются даже гетерозиготы по делеции в гене CCR5 [McNicholl J. et al., 1997]. Наличие большого количество таких гомозигот и гетерозигот среди европейцев свидетельствует о том, что они уже сталкивались с эпидемиями СПИДа. Они и привели к «отбору» генотипов, относительно устойчивых к ВИЧ. Следовательно, повышенную частоту встречаемости 32 bр делеций гена CCR5 в популяции можно рассматривать как своеобразный генетический шрам, оставленный прошлыми эпидемиями СПИДа. Остаются не ясными причины, благодаря которым африканцы, контактировавшие с природным резервуаром ВИЧ среди африканских приматов, оказывается, менее с ним знакомы, чем европейцы. Этот вопрос мы рассмотрим в главе 3.
Из генов других хемокиновых рецепторов, мутации в которых снижают восприимчивость человека к ВИЧ, исследователи отмечают производные CCR2. Замена в 64 позиции гена валина изолейцином приводит к тому же эффекту, что и делеция 32 bр в гене CCR5. Эффект обоих мутаций на прогрессирование ВИЧ-инфекции является аддитивным [McNicholl J., 1998].
Роль МНС в устойчивости к ВИЧ. Было показано, что на передачу ВИЧ-1 от инфицированной женщины ее потомству во время беременности и родов влияют аллели DRB1 МНС класса I младенца. Сорок шесть ВИЧ-инфицированных и 63 сероревертирующих младенцев, родившихся с пассивноприобретенными анти-ВИЧ антителами, и не ставших инфицированными, типировали, используя автоматический метод ДНК-диагностики. Одна или более DR-13-аллелей, включая DRB1 5*01301, 1302 и 1303 были обнаружены у 15,2% детей, ставших ВИЧ-инфицированными и у 31,7% сероревертирующих младенцев (р = 0,048); эта ассоциация зависела от этнического происхождения ребенка. После аналогичного исследования в отношении других аллельных ассоциаций, выяснилось, что только DR2-аллель DRB1 5*0 1501 ассоциировалась с серореверсией у относящихся к кавказской расе детей. Среди этих младенцев аллель DRB1 5*0 03З011 положительно ассоциировалась с ВИЧ-инфекцией [Singh N. et al., 1997].
По предварительным данным Multi Center AIDS Cohort Study, CCR5 и МНС генотипы влияют на устойчивость к ВИЧ независимо друг от друга. По оценкам специалистов Центра влияние МНС на этот процесс значительно большее, чем у мутаций хемокиновых рецепторов [Kaslow R. et al., 1997].
Таким образом, чувствительность к ВИЧ у различных популяций людей сильно варьирует. Наиболее чувствительными к вирусу являются азиатские и негроидные этнические группы. В тоже время устойчивость к инфицированию вирусом других рас носит относительный характер. Это предполагает невозможность торможения эпидемии СПИДа в результате формирования устойчивых к ВИЧ популяций.
Вирус герпеса saimiri. H. saimiri — онкогенный лимфотропный гамма-герпесвирус — трансформирует человеческие и обезьяньи Т-клетки в условиях in vitro и вызывает лимфомы и лейкемию у различных видов приматов Нового Света. Открытая рамка считывания генома H. saimiri кодирует сильно гликозилированный белок, который выделяется и связывается с гетеродимерными HLA-DR-молекулами МНС класса II. Эти результаты показывают, что открытая рамка считывания может функционировать как иммуномодулятор, способный приводить к иммунопатологии при инфекции H. saimiri [Singh et al., 1997].
Вирус Денге. Исследования L. Zeng и соавт. (1996) позволяют предполагать, что реакция Т-клеток на вирус Денге ограничивается аллелью HLA-DR15.
Вирус гепатита В. Поскольку HLA-антигены класса I содержат сходные с вирусными пептиды, они могут быть важными мишенями для иммуноопосредованного гепатоцитолиза CD8+ CTL при гепатите В. Davenport и соавт. (1995) показали, что HLA-DR13 ассоциируется с резистентностью к гепатиту В.
Вирус гепатита С. У больных, инфицированных вирусом гепатита С, прогноз может быть совершенно разным: у половины пациентов наблюдается хроническая болезнь печени, тогда как у другой половины признаков гистологических изменений, связанных с повреждением печени, не обнаруживают. Иммунные реакции хозяина могут играть важную роль при таких разных результатах. К. Киrоkochi и соавт. (1996) идентифицировали цитотоксический Т-клеточный эпитоп, представленный HLA-A2 в NSS-области вируса гепатита С. В исследовании, проведенном G. Реаnо c соавт. (1994), было установлено, что антиген HLA-DR5 выступает как защитный фактор против тяжелого исхода болезни, вызванной вирусом гепатита С.
Вирус Эпштейна—Барра. Предположение о влиянии реакции CTL на эволюцию вируса Эпштейна—Барра было впервые высказано на основании обнаружения того факта, что вирусные изоляты от высокопозитивных на HLA-A11 людей азиатского происхождения, специфически мутировались в двух иммунодоминант-АИ-ограниченных CTL-эпитопах. Кроме того, В35.01-ограниченные реакции CTL у белых доноров воспроизводимо картируются до одного пептидного эпитопа. Однако большинство изолятов вируса Эпштейна—Барра от людей, живущих там, где преобладал аллель В35.01 (в Гамбии), либо сохраняли последовательность эпитопа CTL, либо несли мутацию, которая сохраняла антигенность. Изменения, ведущие к пониженной антигенности, были обнаружены лишь в небольшом количестве случаев [Singh N. et al., 1997]. Два эпитопа, специфичных для вируса Эпштейна—Барра CTL, идентифицированы общим аллелем HLA-B7 [Hill и соавт., 1995].
Хантавирус Puumala. В то время как в США хантавирусы проявляют себя преимущественно легочными симптомами, в Северной Европе их основным патологическим проявлением является почечный синдром. Хотя большинство инфекций, вызываемых этими вирусами, вероятно имеют субклинические или мягкие формы, у 10% людей болезнь может прогрессировать и приводить к шоку, 5% больных нуждаются в диализе, а некоторые могут даже погибнуть. У тех, кто перенес болезнь в форме почечного синдрома, повреждения почек впоследствии могут проявиться хронической гипертензией. Так как хантавирусы являются вариабельными и обычно передаются «роями», исследователями было предположено, что такие факторы людей, как HLA-гены, сильно влияют на спектр клинических проявлений болезни [McNicholl J., 1998].
Действительно, это было показано в конкретных случаях. Лица, которые экспрессировали гены HLA-B8, переносили болезнь более тяжело. У них болезнь проявлялась пониженным кровяным давлением, повышенным содержанием креатинина в крови. Одновременно наблюдалось большее количество вируса в моче и крови, определяемого с помощью ПЦР. У лиц с HLA-B27 болезнь протекала в мягкой форме. Почти все больные с гаплотипом HLA-A1-B8-DR3, у которых прогрессивно развивался шок, экспрессировали аллель TNF2. Аллель была связана с повышенной продукцией фактора некроза опухолей [Wilson A. et al., 1997].
Возбудитель болезни Лайма. B. burgdorferi — человеческий патоген, передаваемый переносчиками. Вызывает мультисистемную болезнь, поражающую кожу, нервную систему, сердце или суставы. Артриты являются главным поздним проявлением болезни. Хотя все клинические проявления болезни Лайма поддаются лечению антибиотиками, приблизительно 10% больных с артритами имеют хронические воспаления суставов, длящиеся месяцы и даже годы после антибиотикотерапии. У таких пациентов после проведения курса антибиотикотерапии, ПЦР-тесты на ДНК B. burgdorferi в жидкости суставных сумок были отрицательными. Этот факт позволяет предположить, что воспаление сустава может продолжаться даже после того, как спирохеты будут из него удалены, поэтому оно носит не инфекционный характер [McNicholl J., 1998].
Исследование аллелей HLA класса II показало, что аллель HLA-DRB1*0401 связана с хроническими артритами и отсутствием у организма реакции на антибиотикотерапию. Эта аллель связана также с повышенным риском развития тяжелых ревматоидных артритов. При исследовании антительных ответов у пациентов, перенесших болезнь Лайма, реакции иммуноглобулина G (IgG) на поверхностный наружный белок A (OspA) и OspB спирохеты часто обнаруживались в самом начале длительно текущих артритов. После проведения курса лечения у пациентов с HLA-DR4 и антительными ответами на OspA и OspB, артриты продолжались значительно дольше, чем в тех случаях, когда ответы на данные белки отсутствовали [Kalish R. et al., 1993]. Это вызвано тем, что лица, переболевшие болезнью Лайма и страдающие устойчивыми к лечению артритами, обычно имеют Т-клетки, которые взаимодействуют со многими эпитопами OspA, в то время как у лиц, хорошо отвечающих на лечение, они обычно отсутствуют. Т. е. Т-клеточный ответ на OspA у больных с артритами, устойчивыми к лечению, может перекрестно распространяться и на собственный антиген в суставной сумке. И тогда ответ на этот собственный антиген может продолжать вызывать воспаление сустава в течение месяцев или даже лет после удаления из него спирохет [McNicholl J., 1998].
Возбудитель туберкулеза. Устойчивость к туберкулезу (ТВ) сильно варьирует у этнических групп.
Врожденная недостаточность функции фагоцитоза. На хромосоме 2q35 человека был идентифицирован ген NRAMP1, гомологичный мышиному Bcg-гену, который придает мышам резистентность к бациллам Кальмета и Герена и к возбудителю лепры (палочка Гансена). Хотя все четыре мутантных типа этого гена были связаны с ТВ, два из них обнаружены у больных туберкулезом в особенно большом количестве. Отдельные аллели гена с необыкновенно высокой частотой преобладают в восточно-африканской популяции, но редко встречаются в европейских. Это наблюдение может частично объяснить более высокую, в сравнении с другими этническими группами, чувствительность африканцев к туберкулезу. Хотя физиологическая функция гена NRAMP1 точно не определена, она может иметь отношение к функции фагоцитолиза [McNicholl J., 1998].
Врожденная недостаточность системы интерферона. Мутация в гамма-интерфероновом рецепторе 1 (IFNгаммаRl) приводит к диссеминации малопатогенных микобактерий. Ген IFNгаммаRl расположен в регионе хромосомы 6q22q23. Мутация в гене приводит к отсутствию экспрессии рецептора на поверхности клеток. Мутация часто обнаруживается в семьях больных туберкулезом [Newport M. et al., 1996].
Врожденная низкая усвояемость витамина D. В случаях ТВ, но не в контролях, также наблюдается низкая встречаемость генотипа, гомозиготного по мутантному рецептору витамина D. Одновременно этот генотип ассоциируется с повышенным риском развития остеопорозов [McNicholl J., 1998].
Связь восприимчивости с МНС. Выявлена связь между легочной формой ТВ и специфичностью HLA. HLA-DR2 ассоциируется с развитием множественно-палочковидных форм как ТВ, так и лепры. Молекулярное субтипирование DR2 показало, что значительную часть аллеля у больных, но не контролей, составляли DRB1 5+ 01501 и DRB1 5+ 01502. Частота этих молекулярных подтипов DR2 у больных не изменялась, позволяя предположить, что вся молекула DR2 или тесно связанный с ней ген(ы) способны определять восприимчивость больного к легочному ТВ и, в частности, к ТВ резистентному к лекарственным препаратам [Singh N. et al., 1997].
Mycobacterium leprae. Роль в развитии лепры врожденной недостаточности функции фагоцитоза, связанной с мутантной аллелью гена NRAMP1 на хромосоме человека 2q35, рассмотрена выше (см «Возбудитель туберкулеза»).
HLA-аллели модулируют иммунную реакцию, определяющую форму лепры. На одном полюсе клинического спектра лепры находятся больные с мультибациллярной (multibacillary) лепроматозной лепрой (LL), которые являются иммунологически толерантными к антигенам М. leprae. На другом — больные с туберкулоидной лепрой (ТТ) с малым количеством палочек (paucibacillary), обнаруживающие хорошую клеточно-опосредованную иммунную реакцию. Гуморальный иммунитет присутствует по всему спектру, но, по-видимому, не обеспечивает защиты. Между двумя полюсами находятся больные с промежуточными признаками, как при погранично-лепроматозной, пограничной, и погранично-туберкулоидной формах. Было зарегистрировано увеличение частоты HLA-DR2 и — DQ1 у больных с LL и HLA-DR3 у больных с ТТ. Эти антигены можно еще подразделить на аллели, определенные по их аминокислотным последовательностям. Одна аминокислотная замена может привести к появлению аллелей с различными иммунологическими свойствами. Аллель DRB1 5*01501 больше ассоциировался с больными LL, чем с больными ТТ (р<0,00001). Кроме того, аллели DQB1 5*00601 обнаруживали значительно чаще у больных с LL, чем у контрольных больных (р<0,00001); DQA1 5*00103 чаще встречался в группе с LL, чем в группе с туберкулезной лепрой; и частота DQA1 5*00102 избирательно повышалась у больных с погранично-лепроматозной лепрой. Однако частота аллелей DRB1 5*00701, DQB1 5*00201 и DQA1 5*00201 снижалась у больных LL по сравнению с больными ТТ и контрольными пациентами, а частота DQB1 5*00503 избирательно уменьшалась у больных ТТ, позволяя предположить, что эти аллели могли модулировать иммунную реакцию, которая определяет форму лепры, развивающуюся у каждого больного [Rani R. et al., 1993].
Малярия. Естественная устойчивость к паразитарным болезням носит более сложный характер, чем к бактериальным и вирусным. Известно три вида естественной устойчивости к малярии [Шувалова Е.П., 1973]:
1. Абсолютная устойчивость, например, невосприимчивость обезьян резус к P. vivax.
2. Фазовая устойчивость, относящаяся к определенным стадиям паразита. Тканевые клетки могут быть восприимчивы, а кровь иммунна, как, например, в случае устойчивости обезьяны шимпанзе к P. ovale.
3. Неполная устойчивость, заключающаяся в том, что развиваться могут все стадии паразита, но их размножение ограничено (например, устойчивость у шимпанзе к P. vivax).
Малярийные плазмодии — это первый, ставший известным, фактор отбора, оставивший «генетические шрамы» в отдельных человеческих популяциях.
Роль генетических дефектов гемоглобина в устойчивости к малярии. Duffy-мутация является единственной защитой хозяина против P. vivax, не приводящая к другим серьезным последствиям (Duffy-антиген — рецептор хемокинов; см. табл. 27). Такие гемопоэтические модификации, как талассемия, G6PD-дефицитность и гемоглобин S, препятствуют развитию плазмодия, но у гомозиготных людей они сами становятся причиной развития серьёзных болезней [Lederberg J., 1997].
Наиболее изученным генетическим дефектом гемоглобина, препятствующим развитию малярийного плазмодия, является замена глутамина на валин в шестом положении (бета-цепи гемоглобина; гемоглобин HbS). Указанное замещение серьезно отразилось на функциональных свойствах гемоглобина. HbS в восстановленной форме образует длинные ассоциированные цепи, его растворимость снижается на 50% по сравнению с растворимостью окисленной формы. Эти особенности гемоглобина определяют укорочение жизни эритроцитов в связи со снижением их толерантности к гемолизу [Бышевский А.Ш., Тарсенов О.А., 1994]. У гомозиготных людей в детском возрасте серповидноклеточная анемия отличается более тяжелым течением и высокой летальностью. Она осложняется калькулезными холециститами, язвами конечностей (в области лодыжек), остеомиелитами, переломами костей, ретинопатией, гематурией, тромбозами сосудов головного мозга и другими тяжелыми клиническими симптомами. Однако у гетерозигот болезнь проявляется в менее тяжелой форме, но при этом люди с HbS формой гемоглобина не заболевают малярией. Даже трудно себе представить цену, уплаченную человеческими популяциями в эндемичных по малярии регионах Африки «демону Дарвина», за частоту аллеля серповидноклеточности в 20% (рис. 53).
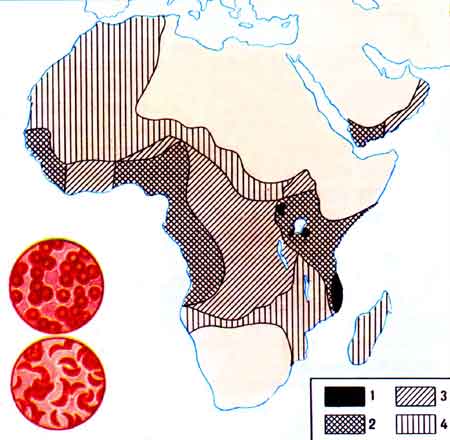
Рис. 53. Распространение серповидно-клеточной анемии в Африке. Малярийные плазмодии — это первый, ставший известным, фактор отбора, оставивший «генетические шрамы» в отдельных человеческих популяциях. В ряде районов Африки распространена наследственная болезнь — серповидно-клеточная анемия. Эритроциты больного человека принимают форму серпа и часто разрушаются, возникает тяжелое малокровие, в результате чего человек отстает в развитии и даже погибает. Казалось бы отбор должен в течение одного-двух поколений устранить этот летальный ген серповидно-клеточности. Но оказалось, что в полной мере эта болезнь проявляется только у гомозиготных по данному локусу людей. У гетерозигот анемия проявляется в менее выраженной форме, но вместе с тем они обладают невосприимчивостью к другой страшной и смертельной в этих местах болезни — малярии. Поэтому там, где есть малярия, естественный отбор поддерживает динамическое равновесие между концентрацией летального серповидно-клеточного аллеля и частотой «здорового» аллеля, или, как принято говорить у эволюционных биологов, поддерживает в популяции балансированный полиморфизм.
Частота аллеля серповидно-клеточности: 1–15–20%; 2–10–15%; 3–5–10%; 4 — менее 5% [Медников Б.М., Яблоков А.В., 1987].
Роль комплекса HLA в устойчивости к малярии. Поскольку существуют значительные различия между экспонируемыми и неэкспонируемыми малярией людьми в частотах HLA-генов по локусам А и В, HLA-комплекс может защищать население на эндемичных по этой болезни территориях от паразитов, вызывающих малярию. Адекватные механизмы могут экспрессироваться HLA-ассоциированными генами, которые контролируют иммунологическую реактивность к антигенам малярии. Хорошо установлена связь между HLA-антигеном класса I, HLA-B53, и защитой от тяжелой формы малярии [Hill A. et al., 1992]. Эта связь может быть опосредованна ограниченными HLA класса I цитотоксическими Т-лимфоцитами на стадии пребывания паразита в печени. Среди иммунных к малярии африканцев НLА-В53-ограниченные CTL распознавали сохраненный неамерпептид из антигена, специфического для печеночной стадии, но ни один НLА-В53-ограниченный эпитоп не был идентифицирован в антигенах из других стадий развития паразита [Нill A. et al., 1992]. Эти данные демонстрируют возможную молекулярную основу для установления связи HLA с болезнью и поддерживают кандидатуру антигена, специфического для стадии печени, в качестве компонента вакцины против малярии [Singh N. et al., 1997].
Роль гена фактора некроза опухолей в клинических проявлениях малярии. Независимо от HLA-аллелей, аллель TNF2 гена фактора некроза опухолей альфа, показана как фактор, способствующий развитию церебральных форм малярии [McGuire W. et al., 1994]. От распространенного аллеля TNF1, TNF2 отличает более сильный транскрипционный активатор, способствующий увеличению экспрессии TNF-альфа. Видимо по этой причине у больных с церебральными формами малярии обычно находят повышенное содержание в крови TNF-альфа [Miller L., 1996]. Эта же аллель способствует более тяжелому течению инфекции, вызываемой хантавирусом Puumala (см. «Хантавирус Puumala»).
Роль гена внутриклеточного фактора адгезии 1 в клинических проявлениях малярии. Отдельные аллели гена ISAM-1 способствуют повышенной адгезии паразита к клеткам красной крови в эндотелии небольших сосудов, это сопровождается повышением чувствительности людей к церебральным формам малярии [Fernandez-Reyes D. et al., 1997].
Шистосоматоз. В исследованиях, проведенных с помощью сегрегационного анализа, показано, что среди населения Бразилии ген SM1 несет ответственность за 66% случаев тяжелого течения болезни (рис. 54). Приблизительно 3% бразильцев гомозиготны по этому гену и предрасположены к тяжелым формам течения болезни (АА-лица), 68% гомозиготны по резистентности шистосоматозу (аа-лица), 29% гетерозиготны и имеют промежуточный уровень резистентности к паразиту (Аа-лица ).
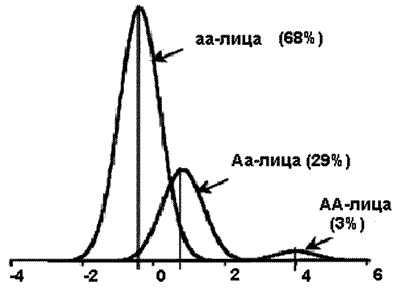
Рис. 54. Распределение гена, определяющего чувствительность популяции к возбудителю инфекционной болезни. На схеме показана частота аллеля А гена SM1, предрасполагающего к развитию шистосоматоза, среди населения Бразилии [Abel L., Desseint A., 1998].
Ген SM1 картирован в регионе хромосомы 5q31-q33, ответственном за контроль дифференциации Т-лимфоцитов [Marquet S. et al., 1996]. В дальнейших исследованиях этот регион был связан и с локусом, отвечающим за синтез иммуноглобулина Е (IgE) и образование эозинофилов. В регуляции устойчивости человека к шистосоматозу ген SM1 участвует через регулирование лимфокинами популяций Th2. Резистентные гомозиготы усиливают Th0/2-ответ, в тоже время чувствительные гомозиготы проявляют в отношении паразита Th0/1-ответ [Abel L., Desseint A., 1998].
***
Восприимчивость к возбудителю инфекционной болезни человеческой популяции или этнической группы всегда носит полигенный характер и определяется частотами встречаемости генов, продукты экспрессии которых способны усилить инфекционный процесс. Частоты таких генов в популяциях варьируют. Поэтому в любой популяции наблюдается множество переходных вариантов патологии между типичными формами проявления инфекционной болезни.
Генетическая устойчивость к развитию микробной инфекции может включать устойчивость к возникновению инфекции, т. е. устойчивость в первоначальной стадии размножения микроорганизма в хозяине и устойчивость к дальнейшему развитию болезни, т. е. Удержание инфекции в состоянии латентности. Генетическая устойчивость к паразитарным болезням носит более сложный характер, чем к бактериальным и вирусным, и предполагает наличие фазовой устойчивости, относящейся к определенным стадиям развития паразита.
Генетическая устойчивость (предрасположенность) к отдельным возбудителям инфекционных болезней может реализовываться непосредственно через иммунную систему и минуя её. Среди факторов иммунной системы, специфически связанных с развитием отдельных инфекций, наиболее изучена роль факторов, кодируемых генами МНС, ассоциации с инфекциями отдельных аллелей которых имеют универсальный характер. Показана роль в развитии инфекционных болезней мутаций генов регулирующих функцию фагоцитолиза (например, NRAMP1 для возбудителей ТВ и лепры); регулирующих активность иммунной системы (например, врожденная недостаточность системы интерферона при ТВ); контролирующих дифференциацию Т-лимфоцитов (например, дефектный ген SM1 при шистосоматозе) и др.
Среди генетических факторов, специфически влияющих на чувствительность к возбудителям инфекций, но не реализующихся через иммунную систему, можно выделить следующие: мутации в рецепторах, нарушающих механизм лиганд-рецепторного взаимодействия возбудителя с клеткой-мишенью (например, Duffy-мутация повышает устойчивость эритроцитов к малярийным плазмодиям, мутации гена рецептора CCR5 снижает риск инфицирования ВИЧ); мутации в субстратах, метаболизируемых узкоспециализированным паразитом (например, генетические дефекты гемоглобина определяют устойчивость к плазмодиям, вызывающим малярию); мутации в генах рецепторов, нарушающих взаимодействие клетки с витамином D и др.
Устойчивость к инфицированию возбудителями инфекционных болезней у рас, этнических групп, отдельных популяций, всегда носит относительный характер. После каждой крупной эпидемии из-за элиминации отдельных генотипов, чувствительность популяции меняется в отношении нескольких возбудителей инфекционных болезней одновременно.
